[CAS-nr. 5402-55-1] 2-Thiopheneethanol
produktstandard
| Udseende | Tørrefri til lysegul gennemsigtig væske |
| Identitetstest | Retentionstid til er i overensstemmelse med reference fra GC |
| Renhed | 99 % min. (GC)) |
| 3-thiopenethanol | 0,1 % maks. (GC) |
| Individuel urenhed (ukendt) | 0,2 % maks. (GC) |
| Vandindhold | 0,3 % maks. (W/W) |
| Gentest periode | Et år |
Produktdetaljer for [ 5402-55-1 ]
| CAS nr.: | 5402-55-1 | MDL nr.: | MFCD00005462 |
| Formel: | C6H8OS | Kogepunkt : | 223°C ved 760 mmHg |
| Lineær strukturformel: | - | InChI nøgle: | N/A |
| MW: | 128,19g/mol | Pubchem ID: | 79400 |
| Synonymer: | |||
Beregnet kemi af [ 5402-55-1 ]
Fysisk-kemiske egenskaber
| Nummer.tunge atomer: | 8 |
| Nummer.arom.tunge atomer: | 5 |
| Brøk Csp3: | 0,33 |
| Nummer.roterbare bindinger: | 2 |
| Nummer.H-binding acceptorer: | 1.0 |
| Nummer.H-binding donorer: | 1.0 |
| Molær refraktivitet: | 35,25 |
| TPSA: | 48,47Ų |
Farmakokinetik
| GI absorption: | Høj |
| BBB permeant: | Ja |
| P-gp substrat: | No |
| CYP1A2 hæmmer: | No |
| CYP2C19 hæmmer: | No |
| CYP2C9 hæmmer: | No |
| CYP2D6 hæmmer: | No |
| CYP3A4 hæmmer: | No |
| Log Kp (hudgennemtrængning): | -6,18 cm/s |
Lipofilicitet
| Log Po/w (iLOGP): | 1,75 |
| Log Po/w (XLOGP3): | 1,27 |
| Log Po/w (WLOGP): | 1,28 |
| Log Po/w (MLOGP): | 0,84 |
| Log Po/w (SILICOS-IT): | 2,67 |
| Konsensuslog Po/w : | 1,56 |
Narkotikalighed
| Lipinski: | 0,0 |
| Ghose: | Ingen |
| Veber: | 0,0 |
| Egan: | 0,0 |
| Muegge: | 1.0 |
| Biotilgængelighedsscore: | 0,55 |
Vandopløselighed
| Log S (ESOL): | -1,77 |
| Opløselighed: | 2,2 mg/ml;0,0172 mol/l |
| Klasse: | Meget opløselig |
| Log S (Ali): | -1,89 |
| Opløselighed: | 1,66 mg/ml;0,013 mol/l |
| Klasse: | Meget opløselig |
| Log S (SILICOS-IT): | -1,86 |
| Opløselighed: | 1,77 mg/ml;0,0138 mol/l |
| Klasse: | Opløselig |
Medicinsk kemi
| SMERTER: | 0,0 alarm |
| Brenk: | 0,0 alarm |
| Blylighed: | 1.0 |
| Syntetisk tilgængelighed: | 1,82 |
Sikkerhed ved [ 5402-55-1 ]
| Signalord: | Advarsel | Klasse: | N/A |
| Sikkerhedserklæringer: | P261-P305+P351+P338 | UN#: | N/A |
| Faresætninger: | H302-H315-H319-H335 | Pakkegruppe: | N/A |
| GHS piktogram: |  | ||
Sikkerhedserklæringer-generelt
| Kode | Udtryk |
| P101 | Hvis lægehjælp er nødvendig, skal du have produktbeholder eller etiket ved hånden. |
| P102 | Holde utilgængeligt for børn. |
| P103 | Læs etiketten før brug |
Forebyggelse
| Kode | Udtryk |
| P201 | Indhent særlige instruktioner før brug. |
| P202 | Må ikke håndteres, før alle sikkerhedsforanstaltninger er læst og forstået. |
| P210 | Holdes væk fra varme/gnister/åben ild/varme overflader.- Rygning forbudt. |
| P211 | Spray ikke på åben ild eller anden antændelseskilde. |
| P220 | Hold/opbevar væk fra tøj/brændbare materialer. |
| P221 | Tag alle forholdsregler for at undgå blanding med brændbare stoffer |
| P222 | Tillad ikke kontakt med luft. |
| P223 | Holdes væk fra enhver mulig kontakt med vand på grund af voldsom reaktion og mulig lynild. |
| P230 | Hold vådt |
| P231 | Håndteres under inert gas. |
| P232 | Beskyt mod fugt. |
| P233 | Hold beholderen tæt lukket. |
| P234 | Opbevares kun i original beholder. |
| P235 | Slap af |
| P240 | Jord/bind beholder og modtageudstyr. |
| P241 | Brug eksplosionssikkert elektrisk/ventilations-/belysnings-/udstyr. |
| P242 | Brug kun gnistfrit værktøj. |
| P243 | Tag forholdsregler mod statisk elektricitet. |
| P244 | Hold reduktionsventiler fri for fedt og olie. |
| P250 | Må ikke udsættes for slibning/stød/friktion. |
| P251 | Trykbeholder: Må ikke gennembores eller brændes, heller ikke efter brug. |
| P260 | Indånd ikke støv/røg/gas/tåge/dampe/spray. |
| P261 | Undgå indånding af støv/røg/gas/tåge/dampe/spray. |
| P262 | Må ikke komme i øjnene, på huden eller på tøjet. |
| P263 | Undgå kontakt under graviditet/under amning. |
| P264 | Vask hænder grundigt efter håndtering. |
| P265 | Vask huden grundigt efter håndtering. |
| P270 | Spis, drik eller ryg ikke, når du bruger dette produkt. |
| P271 | Brug kun udendørs eller i et godt ventileret område. |
| P272 | Forurenet arbejdstøj bør ikke slippes ud af arbejdspladsen. |
| P273 | Undgå udledning til miljøet. |
| P280 | Bær beskyttelseshandsker/beskyttelsestøj/øjenværn/ansigtsbeskyttelse. |
| P281 | Brug personlige værnemidler efter behov. |
| P282 | Bær kuldeisolerende handsker/ansigtsskærm/øjenværn. |
| P283 | Bær brand-/flammebestandigt/hæmmende tøj. |
| P284 | Bær åndedrætsværn. |
| P285 | Brug åndedrætsværn i tilfælde af utilstrækkelig ventilation. |
| P231 + P232 | Håndteres under inert gas.Beskyt mod fugt. |
| P235 + P410 | Slap af.Beskyt mod sollys. |
Respons
| Kode | Udtryk |
| P301 | VED INDTAGELSE: |
| P304 | VED INDÅNDING: |
| P305 | HVIS I ØJNENE: |
| P306 | HVIS PÅ TØJ: |
| P307 | HVIS afsløret: |
| P308 | HVIS udsat eller bekymret: |
| P309 | HVIS du bliver eksponeret, eller hvis du føler dig utilpas: |
| P310 | Ring omgående til en GIFTINFORMATION eller en læge. |
| P311 | Ring til en GIFTINFORMATION eller en læge. |
| P312 | Ring til et GIFTINFORMATIONSCENTRAL eller læge/læge, hvis du føler dig utilpas. |
| P313 | Få lægehjælp/opmærksomhed. |
| P314 | Søg lægehjælp, hvis du føler dig utilpas. |
| P315 | Søg øjeblikkelig lægehjælp. |
| P320 | |
| P302 + P352 | VED KONTAKT MED HUDEN: vask med rigeligt vand og sæbe. |
| P321 | |
| P322 | |
| P330 | Skyl munden. |
| P331 | Fremkald IKKE opkastning. |
| P332 | HVIS der opstår hudirritation: |
| P333 | Hvis der opstår hudirritation eller udslæt: |
| P334 | Nedsænk i koldt vand/indpakning og våde bandager. |
| P335 | Børst løse partikler af huden. |
| P336 | Tø frostede dele op med lunkent vand.Gnid ikke det berørte område. |
| P337 | Hvis øjenirritation fortsætter: |
| P338 | Fjern kontaktlinser, hvis de er til stede og let at gøre.Fortsæt med at skylle. |
| P340 | Flyt tilskadekomne ud i frisk luft og sørg for at hvile i en stilling, der letter vejrtrækningen. |
| P341 | Hvis vejrtrækningen er besværlig, flyt den tilskadekomne til frisk luft og sørg for at hvile i en stilling, der letter vejrtrækningen. |
| P342 | Hvis du oplever luftvejssymptomer: |
| P350 | Vask forsigtigt med rigeligt vand og sæbe. |
| P351 | Skyl forsigtigt med vand i flere minutter. |
| P352 | Vask med rigeligt sæbe og vand. |
| P353 | Skyl huden med vand/bruser. |
| P360 | Skyl straks forurenet tøj og hud med rigeligt vand, før tøj tages af. |
| P361 | Fjern/tag straks alt forurenet tøj af. |
| P362 | Tag forurenet tøj af og vask før genbrug. |
| P363 | Vask forurenet tøj før genbrug. |
| P370 | I tilfælde af brand: |
| P371 | Ved større brand og store mængder: |
| P372 | Eksplosionsrisiko i tilfælde af brand. |
| P373 | Bekæmp IKKE ild, når ilden når sprængstoffer. |
| P374 | Bekæmp ild med normale forholdsregler fra en rimelig afstand. |
| P376 | Stop lækagen, hvis det er sikkert at gøre det.Oxiderende gasser (afsnit 2.4) 1 |
| P377 | Utæt gasbrand: Må ikke slukkes, medmindre lækagen kan stoppes sikkert. |
| P378 | |
| P380 | Evakuer området. |
| P381 | Fjern alle antændelseskilder, hvis det er sikkert at gøre det. |
| P390 | Absorber spild for at forhindre materielle skader. |
| P391 | Saml spild.Farlig for vandmiljøet |
| P301 + P310 | VED INDTAGELSE: Ring omgående til en GIFTINFORMATION eller en læge. |
| P301 + P312 | VED INDTAGELSE: Ring til et GIFTINFORMATIONSCENTRAL eller en læge, HVIS du føler dig utilpas. |
| P301 + P330 + P331 | VED INDTAGELSE: Skyl munden.Fremkald IKKE opkastning. |
| P302 + P334 | HVIS PÅ HUDEN: Nedsænk i koldt vand/pak ind i våde bandager. |
| P302 + P350 | VED KONTAKT MED HUDEN: Vask forsigtigt med rigeligt vand og sæbe. |
| P303 + P361 + P353 | VED KONTAKT MED HUDEN (eller håret): Fjern/tag omgående alt forurenet tøj af.Skyl HUD med vand/bruser. |
| P304 + P312 | VED INDÅNDING: Ring til et GIFTINFORMATIONSCENTRAL eller en læge, hvis du føler dig utilpas. |
| P304 + P340 | VED INDÅNDING: Flyt tilskadekomne ud i frisk luft og sørg for at hvile i en stilling, der letter vejrtrækningen. |
| P304 + P341 | VED INDÅNDING: Hvis vejrtrækningen er besværlig, flyt den tilskadekomne til frisk luft og sørg for at hvile i en stilling, som letter vejrtrækningen. |
| P305 + P351 + P338 | VED KONTAKT MED ØJNENE: Skyl forsigtigt med vand i flere minutter.Fjern kontaktlinser, hvis de er til stede og let at gøre.Fortsæt med at skylle. |
| P306 + P360 | VED PÅ TØJ: Skyl straks forurenet TØJ og HUD med rigeligt vand, før tøj tages af. |
| P307 + P311 | VED eksponering: ring til et GIFTINFORMATIONSCENTRAL eller en læge. |
| P308 + P313 | VED eksponering eller bekymring: Søg lægehjælp. |
| P309 + P311 | VED eksponering eller hvis du føler dig utilpas: Ring til et GIFTINFORMATIONSCENTRAL eller en læge. |
| P332 + P313 | HVIS der opstår hudirritation: Søg lægehjælp. |
| P333 + P313 | HVIS der opstår hudirritation eller udslæt: Søg lægehjælp. |
| P335 + P334 | Børst løse partikler af huden.Nedsænk i køligt vand/pak ind i våde bandager. |
| P337 + P313 | HVIS øjenirritation fortsætter: Søg lægehjælp. |
| P342 + P311 | HVIS du oplever luftvejssymptomer: ring til et GIFTINFORMATIONSCENTER eller en læge. |
| P370 + P376 | I tilfælde af brand: Stop lækagen, hvis det er sikkert at gøre det. |
| P370 + P378 | I tilfælde af brand: |
| P370 + P380 | I tilfælde af brand: Evakuer området. |
| P370 + P380 + P375 | I tilfælde af brand: Evakuer området.Fjernbekæmp brand på grund af eksplosionsfare. |
| P371 + P380 + P375 | Ved større brand og store mængder: Evakuer området.Fjernbekæmp brand på grund af eksplosionsfare. |
Opbevaring
| Kode | Udtryk |
| P401 | |
| P402 | Opbevares på et tørt sted. |
| P403 | Opbevares på et godt ventileret sted. |
| P404 | Opbevares i en lukket beholder. |
| P405 | Butik aflåst. |
| P406 | Opbevares i korrosionsbestandig/beholder med en modstandsdygtig inderforing. |
| P407 | Oprethold luftspalten mellem stakke/paller. |
| P410 | Beskyt mod sollys. |
| P411 | |
| P412 | Må ikke udsættes for temperaturer over 50 oC/ 122 oF. |
| P413 | |
| P420 | Opbevares væk fra andre materialer. |
| P422 | |
| P402 + P404 | Opbevares på et tørt sted.Opbevares i en lukket beholder. |
| P403 + P233 | Opbevares på et godt ventileret sted.Hold beholderen tæt lukket. |
| P403 + P235 | Opbevares på et godt ventileret sted.Slap af. |
| P410 + P403 | Beskyt mod sollys.Opbevares på et godt ventileret sted. |
| P410 + P412 | Beskyt mod sollys.Må ikke udsættes for temperaturer over 50 oC/122oF. |
| P411 + P235 | Slap af. |
Bortskaffelse
| Kode | Udtryk |
| P501 | Bortskaf indholdet/beholderen til... |
| P502 | Se producenten/leverandøren for information om genvinding/genanvendelse |
Fysiske farer
| Kode | Udtryk |
| H200 | Ustabilt sprængstof |
| H201 | Eksplosiv;masseeksplosionsfare |
| H202 | Eksplosiv;alvorlig projektionsfare |
| H203 | Eksplosiv;brand-, eksplosions- eller projektionsfare |
| H204 | Brand- eller projektionsfare |
| H205 | Kan masse eksplodere i brand |
| H220 | Yderst brandfarlig gas |
| H221 | Brandfarlig gas |
| H222 | Yderst brandfarlig aerosol |
| H223 | Brandfarlig aerosol |
| H224 | Yderst brandfarlig væske og damp |
| H225 | Meget brandfarlig væske og damp |
| H226 | Brandfarlig væske og damp |
| H227 | Brændbar væske |
| H228 | Brandfarligt fast stof |
| H229 | Beholder under tryk: kan sprænge ved opvarmning |
| H230 | Kan reagere eksplosivt selv i fravær af luft |
| H231 | Kan reagere eksplosivt selv i fravær af luft ved forhøjet tryk og/eller temperatur |
| H240 | Opvarmning kan forårsage en eksplosion |
| H241 | Opvarmning kan forårsage brand eller eksplosion |
| H242 | Opvarmning kan forårsage brand |
| H250 | Antændes spontant, hvis det udsættes for luft |
| H251 | Selvopvarmning;kan gå i brand |
| H252 | Selvopvarmende i store mængder;kan gå i brand |
| H260 | Ved kontakt med vand frigives brandfarlige gasser, som kan antændes spontant |
| H261 | Ved kontakt med vand frigives brandfarlig gas |
| H270 | Kan forårsage eller forstærke brand;oxidationsmiddel |
| H271 | Kan forårsage brand eller eksplosion;stærkt oxidationsmiddel |
| H272 | Kan intensivere brand;oxidationsmiddel |
| H280 | Indeholder gas under tryk;kan eksplodere ved opvarmning |
| H281 | Indeholder nedkølet gas;kan forårsage kryogene forbrændinger eller skader |
| H290 | Kan være ætsende for metaller |
Sundhedsfarer
| Kode | Udtryk |
| H300 | Dødelig ved indtagelse |
| H301 | Giftig ved indtagelse |
| H302 | Farlig ved indtagelse |
| H303 | Kan være skadeligt ved indtagelse |
| H304 | Kan være dødeligt, hvis det indtages og kommer i luftvejene |
| H305 | Kan være skadeligt, hvis det indtages og kommer i luftvejene |
| H310 | Dødelig ved hudkontakt |
| H311 | Giftig ved hudkontakt |
| H312 | Farlig ved hudkontakt |
| H313 | Kan være skadeligt ved hudkontakt |
| H314 | Forårsager alvorlige forbrændinger af huden og øjenskader |
| H315 | Forårsager hudirritation |
| H316 | Forårsager mild hudirritation |
| H317 | Kan forårsage en allergisk hudreaktion |
| H318 | Forårsager alvorlig øjenskade |
| H319 | Forårsager alvorlig øjenirritation |
| H320 | Forårsager øjenirritation |
| H330 | Dødelig ved indånding |
| H331 | Giftig ved indånding |
| H332 | Farlig ved indånding |
| H333 | Kan være skadeligt ved indånding |
| H334 | Kan forårsage allergi- eller astmasymptomer eller åndedrætsbesvær ved indånding |
| H335 | Kan forårsage irritation af luftvejene |
| H336 | Kan forårsage døsighed eller svimmelhed |
| H340 | Kan forårsage genetiske defekter |
| H341 | Mistænkt for at forårsage genetiske defekter |
| H350 | Kan forårsage kræft |
| H351 | Mistænkt for at forårsage kræft |
| H360 | Kan skade fertiliteten eller det ufødte barn |
| H361 | Mistænkt for at skade fertiliteten eller det ufødte barn |
| H361d | Mistænkt for at skade det ufødte barn |
| H362 | Kan forårsage skade på ammede børn |
| H370 | Forårsager skader på organer |
| H371 | Kan forårsage skade på organer |
| H372 | Forårsager skade på organer ved langvarig eller gentagen eksponering |
| H373 | Kan forårsage skade på organer ved længerevarende eller gentagen eksponering |
Miljøfarer
| Kode | Udtryk |
| H400 | Meget giftig for vandlevende organismer |
| H401 | Giftig for vandlevende organismer |
| H402 | Skadelig for vandlevende organismer |
| H410 | Meget giftig for vandlevende organismer med langvarige virkninger |
| H411 | Giftig for vandlevende organismer med langvarige virkninger |
| H412 | Skadelig for vandlevende organismer med langvarige virkninger |
| H413 | Kan forårsage langvarige skadelige virkninger på vandlevende organismer |
| H420 | Skader folkesundheden og miljøet ved at ødelægge ozon i den øvre atmosfære |
Anvendelse i syntese af [ 5402-55-1 ]
Opstrøms synteserute af [5402-55-1]
Nedstrøms syntetisk rute for [ 5402-55-1 ]
Opstrøms synteserute af [5402-55-1]
| Udbytte | Reaktionsbetingelser | Operation i eksperiment |
|---|---|---|
| 72 % | Med stamme af zygomycete-svampen S.racemosum MUT 770 i dimethylsulfoxid i 72 timer;Enzymatisk reaktion | 2.3.Biotransformationsforsøg Svampestammer blev fordyrket i petriskåle indeholdende maltekstrakt fast medium (MEA: 20 g L-1 glukose, 20 g L-1 maltekstrakt, 20 g L-1 agar, 2 g L-1 pepton), hvorfra inokulummet til flydende kulturer blev oprettet.Svampen blev podet som konidie-suspension (1 106 konidier/ml) i 50 ml asks indeholdende 40 ml maltekstrakt flydende medium.Kolberne blev inkuberet ved 25 C og blev opretholdt under omrøring (110 rpm). Efter 2 dages forvækst blev en 500 mM opløsning af substratet DMSO tilsat til en startsubstratkoncentration (c0) på 1-5 mM.For hvert substrat blev der kørt tre biologiske replikater. Eksperimentet blev kørt i 3 dage efter tilsætningen af substraterne, i løbet af hvilket tidsrum der blev taget 1 ml prøver med bestemte intervaller (sædvanligvis 24, 48 og 72 timer).Hver prøve blev ekstraheret med EtOAc (500 L), den organiske fase blev tørret over vandfrit Na2S04 og analyseret ved hjælp af GC/MS.I nogle tilfælde (se afsnit 2.4) er isoleringen af det reducerede produkt blevet udført. For hvert sæt biotransformationer blev der brugt en forespørgsel til at måle den initiale biomasse og pH før tilsætning af substratet. Disse parametre blev også evalueret i slutningen af eksperimentet for alle spørgsmålene.Det flydende medium blev adskilt fra biomassen ved iltration og blev brugt til pH-måling, mens myceliet blev tørret ved 60 C i 24 timer for at måle biomassens tørvægt.2-(Thiophen-2-yl)ethanol: fra 2-(thiophen-2-yl)eddikesyre (3,7 mg, 72 procent) og fra methyl-2-(thiophen-2-yl)acetat (24,6 mg, 96 procent).1H NMR (400 MHz, CDCI3, TMS): = 7,20 (m, 1H, heteroaromatisk hydrogen), 6,99 (m, 1H, heteroaromatisk hydrogen), 6,90 (m, 1H, heteroaromatisk hydrogen), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02 (t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCI3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min., m/z128 (M+, 30), 110 (5), 97 (100) |
| 66,5 % | Trin #1: Med lithiumaluminiumtetrahydrid i tetrahydrofuran ved 0 - 20 ℃; Trin #2: Med vand;natriumchlorid i tetrahydrofuran ved 0 ℃; | Trin 9 2-(Thiophen-2-yl)ethanol: Ved ca. 0°C blev en opløsning af thiophen-2-yl-eddikesyre (1,0 g; 7,03 mmol) i tetrahydrofuran (10 ml) dråbevist tilsat til en suspension af lithiumaluminiumhydrid (0,534 g; 14,05 mmol) i tør tetrahydrofuran (10 ml). Blandingen blev omrørt ved omgivelsestemperatur i ca. 4 timer og derefter afkølet til ca. 0°C. Efter tilsætning af en kold mættet natriumchloridopløsning (1 ml) blev blandingen filtreret, og de uorganiske salte blev vasket med tetrahydrofuran og ethylacetat. Filtratet og vaskevæskerne blev kombineret og koncentreret i vakuum til opnåelse af titelforbindelsen som brun olie (0,600 g; 66,5 procent). 1H NMR (400 MHz, CDCI3) δ 1,60 (br, udskiftelig med D2O, 1H), 3,08 (t, J=6,2 Hz, 2H), 3,85 (t, J=6,2 Hz, 2H), 6,87-6,88 (m, 1H), 6,95-6,97 (m, 1H), 7,16-7,25 (m, IH).IR (film) υ 3345, 3105, 2211, 2126, 2090, 1792, 1433, 1138, 972, 737, 699 cm-1MS: 129 (M+1). |
| Udbytte | Reaktionsbetingelser | Operation i eksperiment |
|---|---|---|
| 96 % | Med stamme af zygomycete-svampen S.racemosum MUT 770 i dimethylsulfoxid i 72 timer;Enzymatisk reaktion | 2.3.Biotransformationsforsøg Svampestammer blev fordyrket i petriskåle indeholdende maltekstrakt fast medium (MEA: 20 g L-1 glukose, 20 g L-1 maltekstrakt, 20 g L-1 agar, 2 g L-1 pepton), hvorfra inokulummet til flydende kulturer blev oprettet.Svampen blev podet som konidie-suspension (1 106 konidier/ml) i 50 ml asks indeholdende 40 ml maltekstrakt flydende medium.Kolberne blev inkuberet ved 25 C og blev opretholdt under omrøring (110 rpm). Efter 2 dages forvækst blev en 500 mM opløsning af substratet DMSO tilsat til en startsubstratkoncentration (c0) på 1-5 mM.For hvert substrat blev der kørt tre biologiske replikater. Eksperimentet blev kørt i 3 dage efter tilsætningen af substraterne, i løbet af hvilket tidsrum der blev taget 1 ml prøver med bestemte intervaller (sædvanligvis 24, 48 og 72 timer).Hver prøve blev ekstraheret med EtOAc (500 L), den organiske fase blev tørret over vandfrit Na2S04 og analyseret ved hjælp af GC/MS.I nogle tilfælde (se afsnit 2.4) er isoleringen af det reducerede produkt blevet udført. For hvert sæt biotransformationer blev der brugt en forespørgsel til at måle den initiale biomasse og pH før tilsætning af substratet. Disse parametre blev også evalueret i slutningen af eksperimentet for alle spørgsmålene.Det flydende medium blev adskilt fra biomassen ved iltration og blev brugt til pH-måling, mens myceliet blev tørret ved 60 C i 24 timer for at måle biomassens tørvægt.2-(Thiophen-2-yl)ethanol: fra 2-(thiophen-2-yl)eddikesyre (3,7 mg, 72 procent) og fra methyl-2-(thiophen-2-yl)acetat (24,6 mg, 96 procent).1H NMR (400 MHz, CDCI3, TMS): = 7,20 (m, 1H, heteroaromatisk hydrogen), 6,99 (m, 1H, heteroaromatisk hydrogen), 6,90 (m, 1H, heteroaromatisk hydrogen), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02 (t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCI3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min., m/z128 (M+, 30), 110 (5), 97 (100) |
Nedstrøms syntetisk rute for [ 5402-55-1 ]
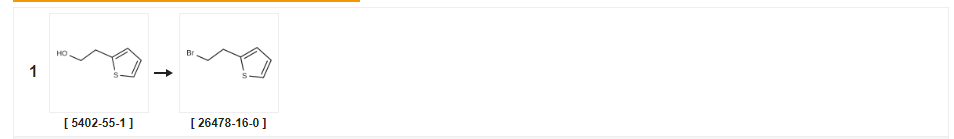
| Udbytte | Reaktionsbetingelser | Operation i eksperiment |
|---|---|---|
| 94 % | Med kulstoftetrabromid;triphenylphosphin i tetrahydrofuran ved 0 ℃;Schlenk teknik;Inert atmosfære; | |
| 69 % | Med brom;triphenylphosphin i dichlormethan ved 20 ℃; | |
| 64 % | S.31 Syntese af 2-(2-bromethyl)thiophen Fremstillingseksempel 31 Syntese af 2-(2-bromethyl)thiophen 2-Thienylethanol (0,44 ml) blev behandlet som i ovenstående fremstillingseksempel 1 til opnåelse af titelforbindelsen (0,490 g) som en farveløs olie (udbytte: 64,0%).1H-NMR (400 MHz, CDCI3): δ(ppm) 3,38 (2H, t, J=7,6 Hz), 3,58 (2H, t, J=7,6 Hz), 6,89 (1H, d, J=1,2 Hz), 6,96 (IH, d, J=4,2 Hz), 7,19 (IH, dd, J=1,2, 4,2 Hz). |
| 28 % | Med phosphortribromid i dichlormethan ved 0 - 20 ℃;i 1 time; | |
| 19 % | Med phosphortribromid i tetrachlormethan ved 65 ℃;i 0,333333 timer; | a Phosphortribromid (2,0 ml, 21,1 mmol) blev tilsat til en omrørt opløsning af 2-(thiophen-2-yl)ethanol (2,25 g, 17,6 mmol) i carbontetrachlorid (162 ml), hvorefter blandingen blev opvarmet til 65°C for 20 minutter.Blandingen fik lov at afkøle til omgivelsestemperatur, hvorefter der blev tilsat is.Det organiske lag blev skilt fra, derefter blev det vandige lag ekstraheret med dichlormethan (2 x 30 ml).De kombinerede organiske lag blev vasket med saltvand, derefter tørret (NaS04), filtreret og reduceret i vakuum.Remanensen blev oprenset ved flashkromatografi over silica under eluering med ethylacetat:hexan-blandinger 0:100 til 0,5:95,5 for at give 2-(2-bromethyl)thiophen som en brun olie (650 mg, 19%). |
| Med pyridin;chloroform;fosfortribromid | ||
| Med phosphortribromid i diethylether ved 0 ℃;i 4 timer; | 2D Eksempel 2D;9-(4,5-dimethyl-thiazol-2-yl)-4-[4-(2-thiophen-2-yl-ethyl)-piperazin-1-yl]-5,6,7, 8-TETRAHYDRO- 1, 3, 4B-TRIAZA-FLUOREN Til en opløsning af 2-(2-thienyl)ethanol (1,63 g) i tør ether (15 ml) ved 0°C sattes PBr3 (1,31 ml) dråbevis.Efter 4 timer blev reaktionsblandingen fortyndet med dichlormethan, vasket med vand, tørret (MGS04), og opløsningsmidlet fjernet i vakuum til opnåelse af en brun olie, som blev oprenset under anvendelse af flashkromatografi til opnåelse af 2-(2-bromethyl)-thiophen.En blanding af 9-(4,5-DIMETHYL-THIAZOL-2-YL)-4-PIPERAZIN-1-YL-5, 6,7, 8-TETRAHYDRO-1, 3, 4b-triaza-fluoren (85 mg), 2-(2-brom-ethyl)-thiophen (44 mg) og kaliumcarbonat (38 mg) blev opvarmet til tilbagesvaling i acetonitril (5 ml) i 4 timer.Reaktionsblandingen blev afkølet, ekstraheret i dichlormethan, tørret (MGS04), og opløsningsmidlet blev fjernet i vakuum til opnåelse af råprodukt, som blev oprenset under anvendelse af flashkromatografi til opnåelse af titelforbindelsen (30 mg). |
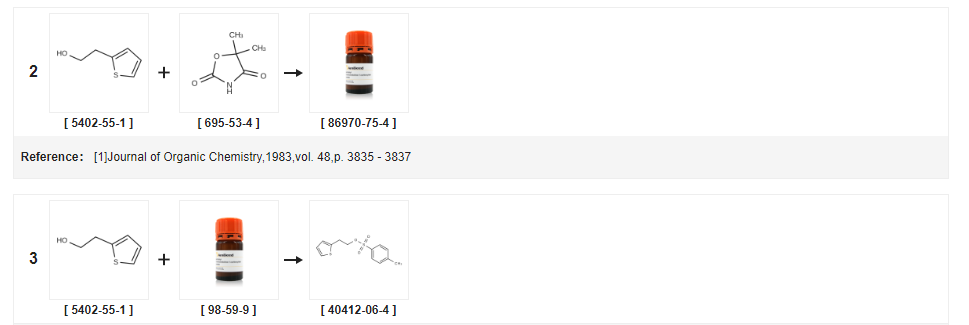
| Udbytte | Reaktionsbetingelser | Operation i eksperiment |
|---|---|---|
| 98 % | Med triethylamin;ved 35 ℃; Afkøling med is; | (0,87 mol) 2-thiophenethanol og 184 g (0,97 mol) p-toluensulfonylchlorid blev sekventielt tilsat til en 1 L trehalset kolbe, 98 g (0,97 mol) triethylamin blev dråbevis tilsat dertil under isvandsbad, Og hold temperaturen af reaktionsvæsken ikke højere end 20°C, drop færdig, opvarmning til 35°C for at fortsætte omrøring, henholdsvis 24 timer, 27 timer prøveudtagning, TLC, indtil reaktionen er afsluttet, stop reaktion, filtrering, filterkage med passende mængde dichlormethan Og methylenchloridlaget blev tørret med vandfrit natriumsulfat i 2 timer.Tørremidlet blev filtreret fra, og tørremidlet blev vasket med en lille mængde methylenchlorid.Filtratet blev dekomprimeret i vakuum, og filtratet blev inddampet under reduceret tryk.Koncentreret til konstant vægt for at være brun olie, der vejer 203 g, udbytte 98%, |
| 96,37 % | Med triethylamin;I toluen;ved 5 - 30 ℃;i 20.8333h;Produktdistribution/selektivitet; | EKSEMPEL 3 Fremstilling af 2-thienylethyl-para-toluensulfonat (formel VII) Under anvendelse af toluen 400 liter toluen og 163,2 kg para-toluensulfonylchlorid blev fyldt i en ren og tør reaktor efterfulgt af afkøling til ca. 5 C. 100 kg thiophen 2-ethanol blev tilsat ved ca. 5°C i løbet af ca. 20 minutter efterfulgt af tilsætning af 130 kg triethylamin i løbet af ca. 8 timer og 50 minutter.Reaktionsblandingens temperatur blev hævet til ca. 30°C efterfulgt af omrøring i ca. 12 timer.Reaktionsmassen blev filtreret gennem et Nutsche-filter og vasket med 2 x 100 liter toluen.Reaktionsfiltratet blev overført til en anden reaktor efterfulgt af vask med 5 x 200 liter vand.Organiske og vandige lag blev adskilt, og det organiske lag blev destilleret fuldstændigt ved ca. under 70°C under vakuum for at give 212 kg (udbytte: 96,37%) af titelforbindelsen.Renhed ved GC: 95,59%. |
| 96,5 % | Med triethylamin;I dichlormethan;ved -5 - 20 ℃;i 2 timer; | 32,7 g (0,17 mol) p-toluensulfonylchlorid, 40 ml dichlormethan i reaktionskolben, afkølet til -5 C, 20 g (0,16 mol) 2-thiophenethanol. 28,4 g (0,28 mol) triethylamin blev langsomt tilsat dråbevis og temperaturen af reaktionsopløsningen blev holdt ved ca. 0 C. Plus Bi, inkuberet i 2 timer efter reaktionen var opvarmet til stuetemperatur.2-thiophenethanol, der skal forbruges, indtil råmaterialerne, sugefiltrering, Faststoffet blev vasket med en lille mængde methylenchlorid, og filtratet blev vasket med 50 ml mættet natriumbicarbonat og tørret over vandfrit natriumsulfat.Filtrering, koncentration af filtratet, lysebrunt fast stof udfældet, Filtreret, vasket med en lille mængde petroleumsether til hvidt, Det vil sige P-toluensulfonat-2-thiophenethylester42,5 g, udbytte 96,5% (HPLC-renhed 99%) |
| 95,5 % | Med triethylamin;I dichlormethan;ved 7,5 - 22,5 ℃;i 5 timer;Produktdistribution/selektivitet; | EKSEMPEL 10 Fremstilling af 2-(2-thiophen)ethanoltosylat (formel VII) Under anvendelse af dichlormethan 4 liter dichlormethan blev tilsat til en reaktor ved en temperatur på ca. 30°C, afkølet til en temperatur på ca. 7,5°C. tilsat 1,784 kg p-toluensulfonylchlorid efterfulgt af 1 kg thiophen-2-ethanol.1,302 kg triethylamin blev tilsat til ovennævnte reaktionsmasse ved en temperatur på ca. 7,5 C efterfulgt af langsomt at hæve temperaturen af reaktionsmassen til 22,5 C i ca. 5 timer.Den opnåede reaktionsmasse blev filtreret gennem et Nutsche-trykfilter, vasket med methylenchlorid (2 x 1 liter), og moderluden blev opsamlet og overført til en anden reaktor.Det organiske lag blev vasket med vand (5 x 2 liter).Det således opnåede organiske lag blev underkastet destillation ved en temperatur under 70 C under anvendelse af varmtvandscirkulation.Den opnåede remanens blev derefter afkølet til ca. 30°C for at give 2,1 kg (udbytte: 95,5%) af titelforbindelsen. |
| 93,6 % | Med triethylamin;I toluen;ved 45 ℃;i 4 timer; | Eksempel 1 0.2.Omdannelse af (S)-1,2,3,4-tetrahydro-5-hvdroxy-N-propyl-naphthalen-2-ammoniumhydrobromid (VIII) til hydrochloridsalt af rotigotin;10.2.1.Fremstilling af 2-(2-Thienyl)ethyl-4-toluensulfonat;4-toluensulfonylchlorid (162 g), toluen (363,3 g) og 2-(2-Thienyl)ethanol (104 g) kombineres.Triethylamin (93 g) tilsættes, idet temperaturen holdes lavere end 45 C. Efter 4 timer vaskes blandingen med vandig phosphorsyre, vandigt natriumhydroxid og derefter vand.Den organiske fase afdestilleres under vakuum.Isopropanol (314 g) og heptaner (365,9 g) tilsættes.Batchen krystalliseres ved afkøling og isoleres ved -15 C. Krystallerne filtreres og vaskes med heptaner (175 ml).Krystallerne tørres derefter under vakuum ved stuetemperatur, indtil et smeltepunkt på > 30 C er opnået. Udbytte (214 g): 93,6 % HPLC-analyser bekræftede renhed > 99 % og 100 % assay i sammenligning med en referencestandard. |
| 93,6 % | Med triethylamin;I toluen;ved 45 ℃;i 4 timer; | 4-toluensulfonylchlorid (162 g), toluen (363,3 g) og 2-(2-Thienyl)ethanol (104 g) kombineres.Triethylamin (93 g) tilsættes, idet temperaturen holdes lavere end 45 C. Efter 4 timer vaskes blandingen med vandig phosphorsyre, vandig natriumhydroxid og derefter vand.Den organiske fase afdestilleres under vakuum.Isopropanol (314 g) og heptaner (365,9 g) tilsættes.Batchen krystalliseres ved afkøling og isoleres ved -15 C. Krystallerne filtreres og vaskes med heptaner (175 ml).Krystallerne tørres derefter under vakuum ved stuetemperatur, indtil der opnås et smeltepunkt på 30 C.Udbytte (214 g): 93,6 % |
| 90 % | Med silicagel;I dichlormethan;i 2 timer; tilbagesvaling; | De 12,8 g (0,1 mol) 2-(2- thienyl) ethanol, 1000 ml dichlormethan, 21,0 g (0,12 mol) p-toluensulfonsyrechlorid og 10,0 g silicagel i reaktionskolben, reaktionsblandingen blev tilbagesvalet i 2 timer, afkølet, filtreret for at fjerne silicagel. Reaktionsblandingen blev vasket successivt med destilleret vand, mættet natriumcarbonatopløsning, saltvand, derefter blev methylenchloridopløsningsmidlet fjernet ved destillation under reduceret tryk for at give 26,0 g p-toluensulfonsyre Fremstilling af 2 -(2-thienyl)ethylester, 90% udbytte. |
| I pyridin;vand; | (a) 2-(2-Hydroxyethyl)thiophentosylat Toluen-4-sulfonylchlorid (4,125 g) blev tilsat portionsvis i løbet af 5 minutter til en iskold opløsning af 2-(2-hydroxyethyl)thiophen (1,723 g) i vandfri pyridin (20 ml), og den resulterende bleggule opløsning blev omrørt ved 0°C. Efter 3 timer blev reaktionsblandingen hældt i kraftigt omrørt vand (160 ml), hvilket gav et bundfald.Efter afkøling blev det faste stof opsamlet og vasket med vand for at give hvide krystaller af titeltosylatet (3,555 g), smp. 33-34°C, lambdamax (EtOH) 227 nm (E11 612). | |
| Med triethylamin;I butanon;ved 0 - 30 ℃; | Eksempel 1 Fremstilling af 2-(2-thienyl)-ethyl-para-toluensulfonat En blanding af p-toluensulfonylchlorid (328 g) og 2-(2-thienyl)-ethanol (200 g) i methylethylketon (1000 ml) blev afkølet til 0C.Dette blev efterfulgt af dråbevis tilsætning af triethylamin (283,1 ml) ved 0-5°C over en periode på 1 til 2 timer, og reaktionsmassen blev omrørt i 12 til 15 timer ved 25-30°C.Den resulterende masse blev filtreret og vasket med methylethylketon (500 ml).Det resulterende organiske lag blev vasket med vand (500 ml) efterfulgt af vask med mættet natriumbicarbonatopløsning (500 ml) og saltvandsopløsning (500 ml).Det resulterende organiske lag blev destilleret under vakuum ved under 50°C for at give 2-(2-thienyl)-ethyl-para-toluensulfonat som en olieagtig masse (olievægt: 505 g; renhed ved HPLC: 97%). | |
| Med triethylamin;I butanon;ved 0 - 30 ℃; | Eksempel 1 Fremstilling af 2-(2-thienyl)-ethyl-para-toluensulfonat En blanding af p-toluensulfonylchlorid (328 g) og 2-(2-thienyl)-ethanol (200 g) i methylethylketon (1000 ml) blev afkølet til 0°C. Dette blev efterfulgt af dråbevis tilsætning af triethylamin (283,1 ml) ved 0-5°C over en periode på 1 til 2 timer, og reaktionsmassen blev omrørt i 12 til 15 timer ved 25-30°C. Den resulterende masse blev filtreret og vasket med methylethylketon (500 ml).Det resulterende organiske lag blev vasket med vand (500 ml) efterfulgt af vask med mættet natriumbicarbonatopløsning (500 ml) og saltvandsopløsning (500 ml).Det resulterende organiske lag blev destilleret under vakuum ved under 50°C for at give 2-(2-thienyl)-ethyl-para-toluensulfonat som en olieagtig masse (olievægt: 505 g; renhed ved HPLC: 97%). | |
| Med kaliumcarbonat;I toluen;ved 0 - 20 ℃;i 3,5 timer; | 500 ml toluen blev tilsat til en 1000 ml reaktionskolbe, 50 g thiophenethanolOg 80 g p-toluensulfonylchlorid, Tænd for omrøring, Reguleret temperatur blev tilsat dråbevis ved 0 C64 g kaliumcarbonat, Tilsætningen blev fortsat i ca. 30 min. afsluttet opvarmning til 20 C reaktion i 3 timer, Til reaktionsopløsningen blev tilsat 400 ml vand, vasket to gange, Det vaskede toluenlag blev direkte brugt til den næste reaktion. | |
| Med N-ethyl-N,N-diisopropylamin;I toluen;ved 0 - 20 ℃;i 3,5 timer; | 500 ml toluen blev tilsat til en 1000 ml reaktionskolbe, 50 g thiophenethanol og 92 g p-toluensulfonylchlorid, omrørt ved 0°C, 62 g N,N-diisopropylethylamin blev tildryppet i ca. 30 minutter.Da tildrypningen var afsluttet, blev blandingen opvarmet til 20 C og reageret i 3 timer.Til reaktionsopløsningen blev tilsat 400 ml vand, vasket to gange, det vaskede toluenlag blev direkte anvendt til den næste reaktion. | |
| Med triethylamin;I toluen;ved 0 - 20 ℃;i 3 timer; | 500 ml toluen, 50 g thiophenethanol og 80 g p-toluensulfonylchlorid blev anbragt i en 1000 ml reaktionskolbe, og temperaturen blev hævet til 20 C i 3 timer.400 ml vand blev tilsat til reaktionsopløsningen, vasket to gange, vasket med toluen, lag direkte til næste reaktionstrin. | |
| Med kaliumcarbonat;I toluen;ved 0 - 20 ℃;i 3,5 timer; | 500 ml toluen, 50 g thiophenethanol og 107 g p-toluensulfonylchlorid blev anbragt i en 1000 ml reaktionskolbe, omrøring blev tændt, temperaturen blev styret til 0 C, dråbevis tilsætning af 64 g kaliumcarbonat, tilsætning varede ca. 30 min., hvorefter det blev opvarmet til 20 C og omsat i 3 timer, blev der til reaktionsopløsningen tilsat 400 ml vand, vasket to gange, og det vaskede toluenlag blev direkte brugt til næste reaktion. | |
| Med triethylamin;I toluen;ved 0 - 25 ℃;i 3,5 timer; | Eksempel 1 Fremgangsmåden til fremstilling af ticlopidinhydrochlorid som vist i fig. 2 omfatter følgende trin:1.p-toluensulfonylbeskyttelse: I en 1000 ml reaktionskolbe blev 500 ml toluen, 50 g thiophenethanol og 80 g p-toluensulfonylchlorid fyldt og omrørt for at kontrollere. Ved en temperatur på 0 C tilsattes dråbevis 47 g triethylamin, 30 minutter, og temperaturen blev hævet til 25 C i 3 timer. Tilsæt 400 ml vand, vasket to gange, vasket med toluenlag direkte til næste reaktionstrin.2.Kondensationsreaktion Reaktionsopløsningen af toluen i det foregående trin blev tilsat til en 1000 ml reaktionskolbe efterfulgt af tilsætning af 114 g o-chlorbenzylamin og opvarmning til 90 C i 3 timer.Efter reaktionen blev blandingen afkølet til 25°C og omrørt i 1 time.Filtratet blev tilsat 200 ml vand, og saltsyre. Indstil systemets pH til 8,5, lag det øverste lag af toluen og fortsæt med at dryppe saltsyre for at justere pH til 5, afkøl derefter systemet til 2 C Krystallerne blev blandet i 4 timer og filtreret, og filterkagen blev tørret i vakuum ved 50 C til opnåelse af 96 g af kondensatet hydrochlorid.Reaktion med lukket kredsløb Til 1000 ml reaktionskolben blev der tilsat 96 g af kondensatet hydrochlorid, 400 ml 1,3-dioxan og 5 ml saltsyre, til 90 C i 6 timer.Efter reaktionen blev blandingen afkølet til 7°C og omrørt i 3 timer.Filterkagen blev vasket med en lille mængde 1,3-dioxetan. Efter 50 C vakuumtørring blev der opnået 95 g ticlopidinhydrochlorid4 ?Raffineret I en 1000 ml reaktionskolbe blev 95 g rå ticlopidinhydrochlorid og 500 ml absolut ethanol tilsat og opvarmet til 72 C under omrøring, ca. 10 minutter efter at det faste stof er fuldstændigt opløst ved tilsætning af 2 g aktivt kul, isoleringsblegning 20 minutter efter varmt filter, filtratet afkøles gradvist. Krystallerne blev krystalliseret ved 4 C i 4 timer og filtreret.Filterkagen blev vasket med en lille mængde absolut ethanol og tørret i vakuum ved 50°C for at give 91 g tithiolhydrochloridPrecision-produkter.Samlet udbytte 82 %, renhed 99,9 % | |
| Med natriumhydroxid;I vand;toluen;ved 10 - 55 ℃;i 11 timer; | I en trehalset kolbe blev 97 g p-toluensulfonylchlorid og 180 ml toluen anbragt. Omrør og opløs, filtrer, hold varm ved 15-20 C, 60 g 2-thiophenethanol og 60 ml toluen blev anbragt i en trehalset kolbe.120 g 40 % vandig natriumhydroxid, under omrøring, En opløsning af 97 g p-toluensulfonylchlorid opløst i 180 ml toluen blev tilsat dråbevis ved 10-20 C, og blandingen blev omrørt i 3 timer, derefter opvarmes til 45-55 C i 8 timer og får lov at henstå til stratificering. Den organiske fase tages af trykket for at fjerne toluen, hvilket giver 2-(2-thiophen)ethanol-p-toluensulfonat. Rødbrun olie;den molekylære formel er som følger: | |
| 235,1 g | Med natriumhydroxid;I chloroform;ved 0 - 5 ℃;i 12 timer; | Til reaktionskolben, ovenstående trin 2-thiophen ethanol: 112 g, chloroform 600 g, PTSC 249,4 g, og blandingen blev afkølet til 0-5 C. Tilsæt 834 g 10 vægt% natriumhydroxidopløsning, kontroller temperaturen 0 -5 C, hold varmt i 12 timer, tilsæt saltsyre til pH=12, lag, vandlaget ekstraheres med 300 g chloroform, og chloroformlaget kombineres.Efter vask med 100 g vand blev det organiske lag destilleret til tørhed for at give 2-thiophenethanol p-toluensulfonat: 235,1 g udbytte 95,3%, renhed 99,5%. |
Skriv din besked her og send den til os

![[ CAS nr. 5402-55-1 ] 2-Thiopheneethanol Udvalgt billede](https://www.ohlsenwin.com/uploads/p1.png)
![[CAS-nr. 5402-55-1] 2-Thiopheneethanol](https://www.ohlsenwin.com/uploads/p1-300x300.png)
![[CAS-nr. 5402-55-1] 2-Thiopheneethanol](https://www.ohlsenwin.com/uploads/product-2-300x300.png)
![[CAS-nr. 5402-55-1] 2-Thiopheneethanol](https://www.ohlsenwin.com/uploads/product-1-300x300.png)





![[CAS-nr. 141109-14-0] (S)-Methyl-2-amino-2-(2-chlorphenyl)acetat](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-2-300x300.png)
![[CAS-nr. 141109-19-5] (S)-Methyl-2-(2-chlorphenyl)-2-((2-(thiophen-2-yl)ethyl)amino)acetathydrochlorid](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-31-300x300.png)
![[CAS-nr. 40412-06-4] 2-(Thiophen-2-yl)ethyl-4-methylbenzensulfonat](https://www.ohlsenwin.com/uploads/ethanol-Tosylate-4-300x300.png)