[ N.º CAS 5402-55-1 ] 2-tiofenoetanol
estándar de producto
| Apariencia | Líquido transparente incoloro a amarillo claro |
| Prueba de identidad | Tiempo de retención conforme a la referencia de GC |
| Pureza | 99 % mín. (GC)) |
| etanol de 3-tiopeneno | 0,1 % máx. (GC) |
| impureza individual (desconocido) | 0,2 % máx. (GC) |
| Contenido de agua | 0,3 % máx. (P/P) |
| Período de repetición de la prueba | Un año |
Detalles del producto de [ 5402-55-1 ]
| No CAS. : | 5402-55-1 | Nº MDL: | MFCD00005462 |
| Fórmula : | C6H8OS | Punto de ebullición : | 223°C a 760 mmHg |
| Fórmula de estructura lineal: | - | Clave InChi: | N / A |
| MW : | 128.19g/mol | ID de Pubchem: | 79400 |
| Sinónimos: | |||
Química calculada de [ 5402-55-1 ]
Propiedades fisicoquímicas
| númeroátomos pesados: | 8 |
| númeroaromaátomos pesados: | 5 |
| Fracción Csp3 : | 0.33 |
| númeroenlaces giratorios: | 2 |
| númeroAceptores de enlaces H: | 1.0 |
| númeroDonantes de bonos H: | 1.0 |
| Refractividad molar: | 35.25 |
| TPSA: | 48.47Ų |
Farmacocinética
| Absorción gastrointestinal: | Alto |
| BBB permeante: | Sí |
| Sustrato P-gp: | No |
| Inhibidor de CYP1A2: | No |
| Inhibidor de CYP2C19: | No |
| Inhibidor de CYP2C9: | No |
| Inhibidor de CYP2D6: | No |
| Inhibidor de CYP3A4: | No |
| Log Kp (permeación de la piel) : | -6,18 cm/s |
lipofilicidad
| Log Po/w (iLOGP) : | 1.75 |
| Log Po/w (XLOGP3) : | 1.27 |
| Log Po/w (WLOGP) : | 1.28 |
| Log Po/w (MLOGP) : | 0.84 |
| Log Po/w (SILICOS-IT) : | 2.67 |
| Registro de consenso Po/w: | 1.56 |
semejanza a las drogas
| Lipinski: | 0.0 |
| Ghose: | Ninguno |
| Veber : | 0.0 |
| egan: | 0.0 |
| muegge: | 1.0 |
| Puntuación de biodisponibilidad: | 0,55 |
Solubilidad del agua
| Registro S (ESOL): | -1.77 |
| Solubilidad : | 2,2 mg/ml;0,0172 mol/l |
| Clase : | muy soluble |
| Registro S (Ali): | -1.89 |
| Solubilidad : | 1,66 mg/ml;0,013 mol/l |
| Clase : | muy soluble |
| Log S (SILICOS-IT) : | -1.86 |
| Solubilidad : | 1,77 mg/ml;0,0138 mol/l |
| Clase : | Soluble |
Química medicinal
| DOLORES : | alerta 0.0 |
| Brenk: | alerta 0.0 |
| Plomo : | 1.0 |
| Accesibilidad sintética: | 1.82 |
Seguridad de [ 5402-55-1 ]
| Palabra clave: | Advertencia | Clase: | N / A |
| Consejos de prudencia: | P261-P305+P351+P338 | NACIONES UNIDAS#: | N / A |
| Declaraciones de peligro: | H302-H315-H319-H335 | Grupo de embalaje: | N / A |
| Pictograma GHS: |  | ||
Declaraciones de precaución-General
| Código | Frase |
| P101 | Si se necesita asesoramiento médico, tenga a mano el envase o la etiqueta del producto. |
| P102 | Mantener fuera del alcance de los niños. |
| P103 | Lea la etiqueta antes de usar |
Prevención
| Código | Frase |
| P201 | Obtenga instrucciones especiales antes del uso. |
| P202 | No manipule hasta que haya leído y entendido todas las precauciones de seguridad. |
| P210 | Mantener alejado del calor/chispas/llamas abiertas/superficies calientes.- No Fumar. |
| P211 | No rocíe sobre una llama abierta u otra fuente de ignición. |
| P220 | Mantener/Almacenar lejos de ropa/materiales combustibles. |
| P221 | Tome todas las precauciones para evitar la mezcla con combustibles. |
| P222 | No permita el contacto con el aire. |
| P223 | Mantener alejado de cualquier posible contacto con el agua, por reacción violenta y posible incendio repentino. |
| P230 | mantener mojado |
| P231 | Manipular bajo gas inerte. |
| P232 | Proteger de la humedad. |
| P233 | Mantener el contenedor bien cerrado. |
| P234 | Mantener solo en el envase original. |
| P235 | Mantener la calma |
| P240 | Contenedor de tierra/fianza y equipo de recepción. |
| P241 | Utilice equipos eléctricos/de ventilación/iluminación/a prueba de explosiones. |
| P242 | Utilice únicamente herramientas que no produzcan chispas. |
| P243 | Tomar medidas de precaución contra las descargas electrostáticas. |
| P244 | Mantenga las válvulas de reducción libres de grasa y aceite. |
| P250 | No lo someta a molienda/golpes/fricción. |
| P251 | Envase presurizado: No perforar ni quemar, incluso después de su uso. |
| P260 | No respire el polvo/el humo/el gas/la niebla/los vapores/el aerosol. |
| P261 | Evite respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol. |
| P262 | No entre en contacto con los ojos, la piel o la ropa. |
| P263 | Evite el contacto durante el embarazo/durante la lactancia. |
| P264 | Lávese bien las manos después de manipular. |
| P265 | Lavar la piel minuciosamente después de la manipulación. |
| P270 | No coma, beba ni fume cuando utilice este producto. |
| P271 | Use solo al aire libre o en un área bien ventilada. |
| P272 | No se debe permitir que la ropa de trabajo contaminada salga del lugar de trabajo. |
| P273 | Evitar su liberación al medio ambiente. |
| P280 | Use guantes protectores/ropa protectora/protección para los ojos/protección para la cara. |
| P281 | Utilice el equipo de protección personal según sea necesario. |
| P282 | Use guantes aislantes contra el frío/máscara/protección para los ojos. |
| P283 | Use ropa ignífuga/resistente al fuego/retardante. |
| P284 | Use protección respiratoria. |
| P285 | En caso de ventilación inadecuada, use protección respiratoria. |
| P231 + P232 | Manipular bajo gas inerte.Proteger de la humedad. |
| P235 + P410 | Mantener la calma.Proteger de la luz solar. |
Respuesta
| Código | Frase |
| P301 | EN CASO DE INGESTIÓN: |
| P304 | SI SE INHALA: |
| P305 | SI EN LOS OJOS: |
| P306 | SI EN LA ROPA: |
| P307 | SI expuesto: |
| P308 | SI expuesto o preocupado: |
| P309 | EN CASO DE exposición o si no se siente bien: |
| P310 | Llamar inmediatamente a un CENTRO DE ENVENENAMIENTO oa un médico. |
| P311 | Llame a un CENTRO DE TOXICOLOGÍA oa un médico. |
| P312 | Llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico si no se siente bien. |
| P313 | Obtener consejo/atención médica. |
| P314 | Consiga consejo/atención médica si no se siente bien. |
| P315 | Obtenga asesoramiento/atención médica inmediata. |
| P320 | |
| P302 + P352 | EN CASO DE CONTACTO CON LA PIEL: lavar con abundante agua y jabón. |
| P321 | |
| P322 | |
| P330 | Enjuague la boca. |
| P331 | No induzca el vomito. |
| P332 | SI ocurre irritación en la PIEL: |
| P333 | Si se produce irritación de la piel o sarpullido: |
| P334 | Sumergir en agua fría/envolver con vendajes húmedos. |
| P335 | Cepille las partículas sueltas de la piel. |
| P336 | Descongele las partes heladas con agua tibia.No frote el área afectada. |
| P337 | Si la irritación de los ojos persiste: |
| P338 | Quítese los lentes de contacto, si tiene y es fácil hacerlo.Continúe enjuagando. |
| P340 | Llevar a la víctima al aire libre y mantenerla en reposo en una posición cómoda para respirar. |
| P341 | Si la respiración es difícil, lleve a la víctima al aire libre y manténgala en reposo en una posición cómoda para respirar. |
| P342 | Si experimenta síntomas respiratorios: |
| P350 | Lavar delicadamente con abundante agua y jabón. |
| P351 | Enjuague cuidadosamente con agua durante varios minutos. |
| P352 | Lavar con abundante agua y jabón. |
| P353 | Enjuague la piel con agua/ducha. |
| P360 | Enjuagar inmediatamente la ropa y la piel contaminadas con abundante agua antes de quitarse la ropa. |
| P361 | Quitar/quitar inmediatamente toda la ropa contaminada. |
| P362 | Quitese la ropa contaminada y lavela antes de reusarla. |
| P363 | Lave la ropa contaminada antes de volver a usarla. |
| P370 | En caso de incendio: |
| P371 | En caso de incendio importante y de grandes cantidades: |
| P372 | Riesgo de explosión en caso de incendio. |
| P373 | NO combata el fuego cuando el fuego alcance los explosivos. |
| P374 | Combata el fuego con las precauciones normales desde una distancia razonable. |
| P376 | Detenga la fuga si es seguro hacerlo.Gases comburentes (sección 2.4) 1 |
| P377 | Incendio con fuga de gas: No lo apague, a menos que la fuga pueda detenerse de manera segura. |
| P378 | |
| P380 | Evacue el área. |
| P381 | Elimine todas las fuentes de ignición si es seguro hacerlo. |
| P390 | Absorba los derrames para evitar daños materiales. |
| P391 | Recoger derrames.Peligroso para el medio ambiente acuático |
| P301 + P310 | EN CASO DE INGESTIÓN: Llamar inmediatamente a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico. |
| P301 + P312 | EN CASO DE INGESTIÓN: llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico SI no se encuentra bien. |
| P301 + P330 + P331 | SI SE INGIERE: Enjuague la boca.No induzca el vomito. |
| P302 + P334 | EN CASO DE CONTACTO CON LA PIEL: sumergir en agua fría/envolver en vendajes húmedos. |
| P302 + P350 | EN CASO DE CONTACTO CON LA PIEL: Lavar suavemente con abundante agua y jabón. |
| P303 + P361 + P353 | EN CASO DE CONTACTO CON LA PIEL (o el cabello): Quitar/quitar inmediatamente toda la ropa contaminada.Enjuague la PIEL con agua/ducha. |
| P304 + P312 | EN CASO DE INHALACIÓN: Llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico si no se siente bien. |
| P304 + P340 | EN CASO DE INHALACIÓN: Transportar a la víctima al aire libre y mantenerla en reposo en una posición cómoda para respirar. |
| P304 + P341 | EN CASO DE INHALACIÓN: Si respira con dificultad, traslade a la víctima al aire libre y manténgala en reposo en una posición cómoda para respirar. |
| P305 + P351 + P338 | EN CASO DE CONTACTO CON LOS OJOS: Enjuagar cuidadosamente con agua durante varios minutos.Quítese los lentes de contacto, si tiene y es fácil hacerlo.Continúe enjuagando. |
| P306 + P360 | EN CASO DE CONTACTO CON LA ROPA: Enjuague inmediatamente la ROPA y la PIEL contaminadas con abundante agua antes de quitarse la ropa. |
| P307 + P311 | EN CASO DE exposición: llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico. |
| P308 + P313 | EN CASO DE exposición o preocupación: Consiga consejo/atención médica. |
| P309 + P311 | EN CASO DE exposición o si no se encuentra bien: llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico. |
| P332 + P313 | SI ocurre irritación en la PIEL: Consiga consejo/atención médica. |
| P333 + P313 | EN CASO DE Irritación o sarpullido en la PIEL: Obtener consejo/atención médica. |
| P335 + P334 | Cepille las partículas sueltas de la piel.Sumergir en agua fría/envolver en vendajes húmedos. |
| P337 + P313 | SI la irritación de los ojos persiste: Consiga consejo/atención médica. |
| P342 + P311 | SI experimenta síntomas respiratorios: llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico. |
| P370 + P376 | En caso de incendio: Detenga la fuga si es seguro hacerlo. |
| P370 + P378 | En caso de incendio: |
| P370 + P380 | En caso de incendio: Evacuar el área. |
| P370 + P380 + P375 | En caso de incendio: Evacuar el área.Combatir el fuego de forma remota debido al riesgo de explosión. |
| P371 + P380 + P375 | En caso de incendio importante y de grandes cantidades: Evacue el área.Combatir el fuego de forma remota debido al riesgo de explosión. |
Almacenamiento
| Código | Frase |
| P401 | |
| P402 | Almacene en un lugar seco. |
| P403 | Almacenar en un lugar bien ventilado. |
| P404 | Almacenar en un recipiente cerrado. |
| P405 | Tienda cerrada con llave. |
| P406 | Almacénelo en un recipiente resistente a la corrosión/ con un forro interior resistente. |
| P407 | Mantenga un espacio de aire entre las pilas/palets. |
| P410 | Proteger de la luz solar. |
| P411 | |
| P412 | No exponer a temperaturas superiores a 50 oC/ 122 oF. |
| P413 | |
| P420 | Almacenar lejos de otros materiales. |
| P422 | |
| P402 + P404 | Almacene en un lugar seco.Almacenar en un recipiente cerrado. |
| P403 + P233 | Almacenar en un lugar bien ventilado.Mantener el contenedor bien cerrado. |
| P403 + P235 | Almacenar en un lugar bien ventilado.Mantener la calma. |
| P410 + P403 | Proteger de la luz solar.Almacenar en un lugar bien ventilado. |
| P410 + P412 | Proteger de la luz solar.No exponer a temperaturas superiores a 50 oC/122oF. |
| P411 + P235 | Mantener la calma. |
Desecho
| Código | Frase |
| P501 | Eliminar el contenido/el recipiente en... |
| P502 | Consulte al fabricante/proveedor para obtener información sobre recuperación/reciclado |
Peligros físicos
| Código | Frase |
| H200 | explosivo inestable |
| H201 | Explosivo;peligro de explosión masiva |
| H202 | Explosivo;grave riesgo de proyección |
| H203 | Explosivo;peligro de incendio, explosión o proyección |
| H204 | Peligro de incendio o proyección |
| H205 | Puede explotar en masa en el fuego |
| H220 | Gas extremadamente inflamable |
| H221 | Gas inflamable |
| H222 | Aerosol extremadamente inflamable |
| H223 | Aerosol inflamable |
| H224 | Líquido y vapor extremadamente inflamables |
| H225 | Líquido y vapor altamente inflamables |
| H226 | Líquidos y vapores inflamables |
| H227 | Líquido combustible |
| H228 | sólido inflamable |
| H229 | Recipiente presurizado: puede reventar si se calienta |
| H230 | Puede reaccionar explosivamente incluso en ausencia de aire. |
| H231 | Puede reaccionar explosivamente incluso en ausencia de aire a presión y/o temperatura elevadas |
| H240 | El calentamiento puede causar una explosión |
| H241 | El calentamiento puede provocar un incendio o una explosión |
| H242 | El calentamiento puede provocar un incendio |
| H250 | Prende fuego espontáneamente si se expone al aire |
| H251 | Auto-calentamiento;puede incendiarse |
| H252 | Autocalentamiento en grandes cantidades;puede incendiarse |
| H260 | En contacto con el agua desprende gases inflamables que pueden inflamarse espontáneamente |
| H261 | En contacto con el agua libera gas inflamable |
| H270 | Puede provocar o intensificar un incendio;oxidante |
| H271 | Puede provocar un incendio o una explosión;oxidante fuerte |
| H272 | Puede intensificar el fuego;oxidante |
| H280 | Contiene gas a presión;puede explotar si se calienta |
| H281 | Contiene gas refrigerado;puede causar quemaduras o lesiones criogénicas |
| H290 | Puede ser corrosivo para los metales. |
Riesgos para la salud
| Código | Frase |
| H300 | Mortal si se traga |
| H301 | Tóxico si se ingiere |
| H302 | Nocivo si se ingiere |
| H303 | Puede ser dañino si se ingiere |
| H304 | Puede ser mortal en caso de ingestión y penetración en las vías respiratorias |
| H305 | Puede ser nocivo si se ingiere y entra en las vías respiratorias |
| H310 | Mortal en contacto con la piel |
| H311 | tóxico en contacto con la piel |
| H312 | Dañino en contacto con la piel |
| H313 | Puede ser nocivo en contacto con la piel |
| H314 | Provoca quemaduras graves en la piel y daños en los ojos. |
| H315 | Provoca irritación de la piel |
| H316 | Provoca irritación leve de la piel. |
| H317 | Puede provocar una reacción alérgica en la piel |
| H318 | Provoca lesiones oculares graves |
| H319 | Provoca irritación ocular grave |
| H320 | Causa irritación en los ojos |
| H330 | Mortal si se inhala |
| H331 | Tóxico si se inhala |
| H332 | Nocivo si se inhala |
| H333 | Puede ser dañino si se inhala |
| H334 | Puede causar síntomas de alergia o asma o dificultades respiratorias si se inhala |
| H335 | Puede causar irritación respiratoria |
| H336 | Puede causar somnolencia o mareos |
| H340 | Puede causar defectos genéticos |
| H341 | Sospechoso de causar defectos genéticos |
| H350 | Puede causar cáncer |
| H351 | Sospechoso de causar cáncer |
| H360 | Puede dañar la fertilidad o el feto |
| H361 | Sospechoso de dañar la fertilidad o el feto |
| H361d | Sospechoso de dañar al feto |
| H362 | Puede causar daño a los niños amamantados |
| H370 | Causa daño a los órganos. |
| H371 | Puede causar daño a los órganos |
| H372 | Provoca daños en los órganos tras exposiciones prolongadas o repetidas |
| H373 | Puede provocar daños en los órganos tras exposiciones prolongadas o repetidas |
Peligros ambientales
| Código | Frase |
| H400 | Muy tóxico para la vida marina |
| H401 | Tóxico para la vida acuática |
| H402 | Nocivo para la vida acuática. |
| H410 | Muy tóxico para los organismos acuáticos, con efectos nocivos duraderos |
| H411 | Tóxico para la vida acuática con efectos duraderos |
| H412 | Nocivo para la vida acuática con efectos duraderos |
| H413 | Puede causar efectos nocivos duraderos para la vida acuática. |
| H420 | Daña la salud pública y el medio ambiente al destruir el ozono en la atmósfera superior |
Aplicación En Síntesis de [ 5402-55-1 ]
Ruta de síntesis aguas arriba de [ 5402-55-1 ]
Ruta sintética aguas abajo de [ 5402-55-1 ]
Ruta de síntesis aguas arriba de [ 5402-55-1 ]
| Producir | Condiciones de reacción | Operación en experimento |
|---|---|---|
| 72% | Con cepa del hongo zygomycete S.racemosum MUT 770 En dimetilsulfóxido durante 72 h;reacción enzimática | 2.3.Experimentos de biotransformación Las cepas fúngicas se precultivaron en placas de Petri que contenían medio sólido maltexttracto (MEA: 20 g L-1 de glucosa, 20 g L-1 de extracto de malta, 20 g L-1 de agar, 2 g L-1 de peptona) a partir del cual se realizó el inóculo. for liquidcultures fue creado.El hongo se inoculó como suspensión de conidios (1 106 conidios/mL) en asks de 50 mL que contenían 40 mL de medio líquido maltexttract.Los matraces se incubaron a 25 C y se mantuvieron en agitación (110 rpm). Después de 2 días de precrecimiento, se añadió una solución 500 mM de la sustratoína DMSO, hasta una concentración inicial de sustrato (c0) de 1–5 mM.Para cada sustrato, se realizaron tres réplicas biológicas. El experimento se realizó durante 3 días después de la adición de los sustratos, tiempo durante el cual se tomaron muestras de 1 ml, a intervalos especificados (generalmente 24, 48 y 72 h).Cada muestra se extrajo con EtOAc (500 L), la fase orgánica se secó sobre Na2SO4 anhidro y se analizó mediante GC/MS.En algunos casos (ver Sección 2.4) se ha llevado a cabo el aislamiento del producto reducido. Para cada conjunto de biotransformaciones, se utilizó una pregunta para medir la biomasa inicial y el pH antes de la adición del sustrato. Estos parámetros también fueron evaluado al final del experimento para todas las preguntas.El medio líquido se separó de la biomasa por filtración y se utilizó para medir el pH mientras que los micelios se secaron a 60 °C durante 24 h para medir el peso seco de la biomasa.2-(tiofen-2-il)etanol: del ácido 2-(tiofen-2-il)acético (3,7 mg, 72 por ciento) y del 2-(tiofen-2-il)acetato de metilo (24,6 mg, 96 por ciento).RMN 1H (400 MHz, CDCl3, TMS): = 7,20 (m, 1H, hidrógeno heteroaromático), 6,99 (m, 1H, hidrógeno heteroaromático), 6,90 (m,1H, hidrógeno heteroaromático), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02(t, 2H, J = 6,2 Hz, CH2CH2OH).RMN de 13C (100 MHz, CDCl3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
| 66,5% | Etapa #1: Con tetrahidruro de litio y aluminio en tetrahidrofurano a 0 - 20 ℃; Etapa #2: Con agua;cloruro de sodio en tetrahidrofurano a 0 ℃; | Paso 9 2-(Tiofen-2-il)etanol: Aproximadamente a 0ºC, se añadió gota a gota una solución de ácido tiofen-2-il-acético (1,0 g; 7,03 mmol) en tetrahidrofurano (10 ml) a una suspensión de hidruro de litio y aluminio (0,534 g; 14,05 mmol) en solución seca. tetrahidrofurano (10 ml). La mezcla se agitó a temperatura ambiente durante aproximadamente 4 horas y luego se enfrió a aproximadamente 0ºC. Después de agregar una solución saturada fría de cloruro de sodio (1 ml), la mezcla se filtró y las sales inorgánicas se lavaron con tetrahidrofurano y acetato de etilo. El filtrado y los lavados se combinaron y concentraron al vacío para dar el compuesto del título como un aceite pardo (0,600 g; 66,5 por ciento). 1RMN H (400 MHz, CDCl3) δ 1.60 (br, intercambiable con D2O, 1H), 3,08 (t, J=6,2 Hz, 2H), 3,85 (t, J=6,2 Hz, 2H), 6,87-6,88 (m, 1H), 6,95-6,97 (m, 1H), 7,16-7,25 (m, 1H).IR (película) υ 3345, 3105, 2211, 2126, 2090, 1792, 1433, 1138, 972, 737, 699 cm-1EM: 129 (M+1). |
| Producir | Condiciones de reacción | Operación en experimento |
|---|---|---|
| 96% | Con cepa del hongo zygomycete S.racemosum MUT 770 En dimetilsulfóxido durante 72 h;reacción enzimática | 2.3.Experimentos de biotransformación Las cepas fúngicas se precultivaron en placas de Petri que contenían medio sólido maltexttracto (MEA: 20 g L-1 de glucosa, 20 g L-1 de extracto de malta, 20 g L-1 de agar, 2 g L-1 de peptona) a partir del cual se realizó el inóculo. for liquidcultures fue creado.El hongo se inoculó como suspensión de conidios (1 106 conidios/mL) en asks de 50 mL que contenían 40 mL de medio líquido maltexttract.Los matraces se incubaron a 25 C y se mantuvieron en agitación (110 rpm). Después de 2 días de precrecimiento, se añadió una solución 500 mM de la sustratoína DMSO, hasta una concentración inicial de sustrato (c0) de 1–5 mM.Para cada sustrato, se realizaron tres réplicas biológicas. El experimento se realizó durante 3 días después de la adición de los sustratos, tiempo durante el cual se tomaron muestras de 1 ml, a intervalos especificados (generalmente 24, 48 y 72 h).Cada muestra se extrajo con EtOAc (500 L), la fase orgánica se secó sobre Na2SO4 anhidro y se analizó mediante GC/MS.En algunos casos (ver Sección 2.4) se ha llevado a cabo el aislamiento del producto reducido. Para cada conjunto de biotransformaciones, se utilizó una pregunta para medir la biomasa inicial y el pH antes de la adición del sustrato. Estos parámetros también fueron evaluado al final del experimento para todas las preguntas.El medio líquido se separó de la biomasa por filtración y se utilizó para medir el pH mientras que los micelios se secaron a 60 °C durante 24 h para medir el peso seco de la biomasa.2-(tiofen-2-il)etanol: del ácido 2-(tiofen-2-il)acético (3,7 mg, 72 por ciento) y del 2-(tiofen-2-il)acetato de metilo (24,6 mg, 96 por ciento).RMN 1H (400 MHz, CDCl3, TMS): = 7,20 (m, 1H, hidrógeno heteroaromático), 6,99 (m, 1H, hidrógeno heteroaromático), 6,90 (m,1H, hidrógeno heteroaromático), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02(t, 2H, J = 6,2 Hz, CH2CH2OH).RMN de 13C (100 MHz, CDCl3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
Ruta sintética aguas abajo de [ 5402-55-1 ]
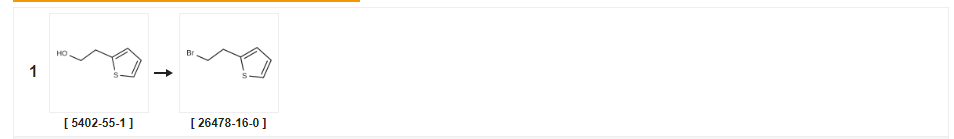
| Producir | Condiciones de reacción | Operación en experimento |
|---|---|---|
| 94% | Con tetrabromuro de carbono;trifenilfosfina en tetrahidrofurano a 0℃;técnica de Schlenk;Atmósfera inerte; | |
| 69% | con bromo;trifenilfosfina en diclorometano a 20 ℃; | |
| 64% | P.31 Síntesis de 2-(2-bromoetil)tiofeno Ejemplo de producción 31 Síntesis de 2-(2-bromoetil)tiofeno Se trató 2-tieniletanol (0,44 ml) como en el Ejemplo de producción 1 anterior para dar el compuesto del título (0,490 g) como un aceite incoloro (rendimiento: 64,0%).RMN 1H (400 MHz, CDCl3): δ(ppm) 3,38 (2H, t, J=7,6 Hz), 3,58 (2H, t, J=7,6 Hz), 6,89 (1H, d, J=1,2 Hz), 6,96 (1H, día, J=4,2 Hz), 7,19 (1H, día, J=1,2, 4,2 Hz). |
| 28% | Con tribromuro de fósforo en diclorometano a 0 - 20 ℃;por 1h; | |
| 19% | Con tribromuro de fósforo en tetraclorometano a 65 ℃;para 0,333333h; | a Se añadió tribromuro de fósforo (2,0 ml, 21,1 milimoles) a una solución agitada de 2-(tiofen-2-il)etanol (2,25 g, 17,6 milimoles) en tetracloruro de carbono (162 ml), luego la mezcla se calentó a 65 °C durante 20 minutos.La mezcla se dejó enfriar a temperatura ambiente y luego se añadió hielo.La capa orgánica se separó y luego la capa acuosa se extrajo con diclorometano (2 x 30 ml).Las capas orgánicas combinadas se lavaron con salmuera, luego se secaron (NaSO4), se filtraron y se redujeron al vacío.El residuo se purificó mediante cromatografía ultrarrápida sobre sílice, eluyendo con mezclas de acetato de etilo:hexano de 0:100 a 0,5:95,5 para dar 2-(2-bromoetil)tiofeno como un aceite marrón (650 mg, 19%). |
| con piridina;cloroformo;tribromuro de fósforo | ||
| Con tribromuro de fósforo en éter dietílico a 0 ℃;por 4 horas; | 2D Ejemplo 2D;9-(4,5-Dimetil-tiazol-2-il)-4-[4-(2-tiofen-2-il-etil)-piperazin-1-il]-5,6,7, 8- TETRAHIDRO- 1, 3, 4B-TRIAZA-FLUORENO A una solución de 2-(2-tienil) etanol (1,63 g) en éter seco (15 ml) a 0ºC se añadió gota a gota PBr3 (1,31 ml).Después de 4 horas, la mezcla de reacción se diluyó con diclorometano, se lavó con agua, se secó (MGS04) y el disolvente se eliminó al vacío para producir un aceite pardo que se purificó mediante cromatografía ultrarrápida para producir 2-(2-bromo-etil)-tiofeno.Una mezcla de 9- (4, 5-DIMETHYL-THIAZOL-2-YL)-4-PIPERAZIN-1-YL-5, 6,7, 8-TETRAHYDRO- 1, 3, 4b-triaza-fluorene (85 mg), Se calentaron a reflujo 2-(2-bromo-etil)-tiofeno (44 mg) y carbonato de potasio (38 mg) en acetonitrilo (5 ml) durante 4 horas.La mezcla de reacción se enfrió, se extrajo en diclorometano, se secó (MGS04) y el disolvente se eliminó al vacío para producir un producto bruto que se purificó mediante cromatografía ultrarrápida para producir el compuesto del título (30 mg). |
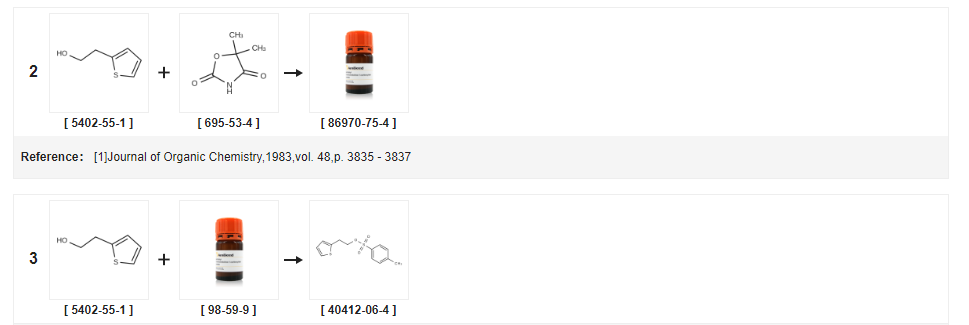
| Producir | Condiciones de reacción | Operación en experimento |
|---|---|---|
| 98% | con trietilamina;a 35 ℃; Refrigeración con hielo; | (0,87 mol) de 2-tiofenetanol y 184 g (0,97 mol) de cloruro de p-toluenosulfonilo se añadieron secuencialmente a un matraz de tres bocas de 1 L, se añadieron gota a gota 98 g (0,97 mol) de trietilamina en un baño de agua con hielo. Y mantenga la temperatura del líquido de reacción no superior a 20 DEG C, termine de caer, calentando a 35 DEG C para continuar agitando, respectivamente 24 h, 27 h de muestreo, TLC, hasta que se complete la reacción, detenga la reacción, filtración, torta de filtración con apropiado cantidad de diclorometano y la capa de cloruro de metileno se secó con sulfato de sodio anhidro durante 2 horas.El desecante se filtró y el desecante se lavó con una pequeña cantidad de cloruro de metileno.El filtrado se descomprimió al vacío y el filtrado se evaporó a presión reducida.Concentrado a peso constante para ser aceite marrón, con un peso de 203 g, rendimiento del 98 %, |
| 96,37% | con trietilamina;en tolueno;a 5 - 30 ℃;para 20.8333h;Distribución/selectividad del producto; | EJEMPLO 3 Preparación de para-toluenosulfonato de 2-tieniletilo (fórmula VII) usando tolueno Se cargaron 400 litros de tolueno y 163,2 kg de cloruro de para-toluenosulfonilo en un reactor limpio y seco seguido de enfriamiento a aproximadamente 5 °C. Se añadió 2-etanol a aproximadamente 5ºC durante aproximadamente 20 minutos, seguido de la adición de 130 kg de trietilamina durante aproximadamente 8 horas y 50 minutos.La temperatura de la mezcla de reacción se elevó a alrededor de 30ºC seguido de agitación durante alrededor de 12 horas.La masa de reacción se filtró a través de un filtro Nutsche y se lavó con 2 x 100 litros de tolueno.El filtrado de reacción se transfirió a otro reactor seguido de lavado con 5 x 200 litros de agua.Las capas orgánica y acuosa se separaron y la capa orgánica se destiló completamente a aproximadamente por debajo de 70 °C al vacío para proporcionar 212 kg (rendimiento: 96,37 %) del compuesto del título.Pureza por GC: 95,59%. |
| 96,5% | con trietilamina;en diclorometano;a -5 - 20 ℃;por 2 horas; | 32,7 g (0,17 mol) de cloruro de p-toluenosulfonilo, 40 ml de diclorometano en el matraz de reacción, enfriado a -5 C, 20 g (0,16 mol) de 2-tiofenoetanol. Se añadieron lentamente gota a gota 28,4 g (0,28 mol) de trietilamina y la temperatura de la solución de reacción se mantuvo a aproximadamente 0 C. Plus Bi, se incubó durante 2 h después de que la reacción se calentara a temperatura ambiente.etanol de 2-tiofeno para ser consumido hasta las materias primas, filtración por succión. El sólido se lavó con una pequeña cantidad de cloruro de metileno y el filtrado se lavó con 50 ml de bicarbonato de sodio saturado y se secó sobre sulfato de sodio anhidro.Filtración, concentración del filtrado, precipitó un sólido marrón claro, filtrado, lavado con una pequeña cantidad de éter de petróleo hasta obtener un color blanco, es decir P-toluenosulfonato-2-tiofeno etil éster 42,5 g, rendimiento 96,5 % (pureza HPLC 99 %) |
| 95,5% | con trietilamina;en diclorometano;a 7,5 - 22,5 ℃;por 5h;Distribución/selectividad del producto; | EJEMPLO 10 Preparación de tosilato de 2-(2-tiofeno)etanol (Fórmula VII) utilizando diclorometano Se añadieron 4 litros de diclorometano a un reactor a una temperatura de aproximadamente 30 C, se enfrió a una temperatura de aproximadamente 7,5 C a la que luego se se añadieron 1,784 kg de cloruro de p-toluenosulfonilo seguido de 1 kg de tiofeno-2-etanol.Se añadieron 1,302 kg de trietilamina a la masa de reacción anterior a una temperatura de aproximadamente 7,5 C seguido de un aumento lento de la temperatura de la masa de reacción a 22,5 C durante aproximadamente 5 horas.La masa de reacción obtenida se filtró a través de un filtro Nutsche a presión, se lavó con cloruro de metileno (2 x 1 litro) y las aguas madres se recogieron y transfirieron a otro reactor.La capa orgánica se lavó con agua (5 x 2 litros).La capa orgánica así obtenida se sometió a destilación a una temperatura por debajo de 70ºC usando circulación de agua caliente.A continuación, el residuo obtenido se enfrió a aproximadamente 30ºC para proporcionar 2,1 kg (rendimiento: 95,5%) del compuesto del título. |
| 93,6% | con trietilamina;en tolueno;a 45 ℃;por 4 horas; | Ejemplo 1 0.2.Conversión de bromhidrato de (S)-1,2,3,4-tetrahidro-5-hidroxi-N-propil-naftalen-2-amonio (VIII) en sal clorhidrato de rotigotina;10.2.1.Preparación de 2-(2-Tienil)etil-4-tolueno sulfonato;Se combinan cloruro de 4-toluenosulfonilo (162 g), tolueno (363,3 g) y 2-(2-tienil)etanol (104 g).Se añade trietilamina (93 g) manteniendo la temperatura por debajo de 45ºC. Después de 4 horas, la mezcla se lava con ácido fosfórico acuoso, hidróxido de sodio acuoso y luego con agua.La fase orgánica se elimina por destilación al vacío.Se añaden isopropanol (314 g) y heptanos (365,9 g).El lote se cristaliza por enfriamiento y se aísla a -15 C. Los cristales se filtran y se lavan con heptanos (175 ml).A continuación, los cristales se secan al vacío a temperatura ambiente hasta que se obtiene un punto de fusión de > 30 C. Rendimiento (214 g): 93,6 % Los análisis HPLC confirmaron una pureza > 99 % y 100 % de ensayo en comparación con un estándar de referencia. |
| 93,6% | con trietilamina;en tolueno;a 45 ℃;por 4 horas; | Se combinan cloruro de 4-toluenosulfonilo (162 g), tolueno (363,3 g) y 2-(2-tienil)etanol (104 g).Se añade trietilamina (93 g) manteniendo la temperatura por debajo de 45ºC. Después de 4 horas, la mezcla se lava con ácido fosfórico acuoso, hidróxido de sodio acuoso y luego con agua.La fase orgánica se elimina por destilación al vacío.Se añaden isopropanol (314 g) y heptanos (365,9 g).El lote se cristaliza por enfriamiento y se aísla a -15 C. Los cristales se filtran y se lavan con heptanos (175 ml).A continuación, los cristales se secan al vacío a temperatura ambiente hasta que se obtiene un punto de fusión de 30ºC.[0255] Rendimiento (214 g): 93,6% |
| 90% | con gel de sílice;en diclorometano;por 2h;Reflujo; | Los 12,8 g (0,1 mol) de 2- (2-tienil) etanol, 1000 ml de diclorometano, 21,0 g (0,12 mol) de cloruro de ácido p-toluenosulfónico y 10,0 g de gel de sílice en el matraz de reacción, la reacción se calentó a reflujo durante 2 h, se enfrió, se filtró para eliminar el gel de sílice. La mezcla de reacción se lavó sucesivamente con agua destilada, solución saturada de carbonato de sodio, salmuera, luego el solvente de cloruro de metileno se eliminó por destilación a presión reducida, para dar 26,0 g de ácido p-toluenosulfónico Preparación de 2 - (2-tienil) éster etílico, 90% de rendimiento. |
| en piridina;agua; | (a) Tosilato de 2-(2-hidroxietil)tiofeno Se añadió cloruro de tolueno-4-sulfonilo (4,125 g) en porciones durante 5 minutos a una solución helada de 2-(2-hidroxietil)tiofeno (1,723 g) en piridina anhidra (20 ml) y la solución de color amarillo pálido resultante se agitó a 0ºC. Después de 3 h, la mezcla de reacción se vertió en agua vigorosamente agitada (160 ml) produciendo un precipitado.Después de enfriar, el sólido se recogió y se lavó con agua para dar cristales blancos del tosilato del título (3,555 g), pf 33-34 C, lambdamax (EtOH) 227 nm (E11 612). | |
| con trietilamina;en butanona;a 0 - 30 ℃; | Ejemplo 1 Preparación de paratoluenosulfonato de 2-(2-tienil)-etilo Una mezcla de cloruro de p-toluenosulfonilo (328 g) y 2-(2-tienil)-etanol (200 g) en metiletilcetona (1000 ml) se enfriado a 0C.Esto fue seguido por la adición gota a gota de trietilamina (283,1 ml) a 0-5°C durante un período de 1 a 2 horas, y la masa de reacción se agitó durante 12 a 15 horas a 25-30°C.La masa resultante se filtró y se lavó con metiletilcetona (500 ml).La capa orgánica resultante se lavó con agua (500 ml) seguido de lavados con solución saturada de bicarbonato de sodio (500 ml) y solución de salmuera (500 ml).La capa orgánica resultante se destiló al vacío por debajo de 50ºC para dar para-toluenosulfonato de 2-(2-tienil)-etilo como una masa oleosa (Peso del aceite: 505 g; Pureza por HPLC: 97%). | |
| con trietilamina;en butanona;a 0 - 30 ℃; | Ejemplo 1 Preparación de paratoluenosulfonato de 2-(2-tienil)-etilo Una mezcla de cloruro de p-toluenosulfonilo (328 g) y 2-(2-tienil)-etanol (200 g) en metiletilcetona (1000 ml) se se enfrió a 0 C. A esto le siguió la adición gota a gota de trietilamina (283,1 ml) a 0-5 C durante un período de 1 a 2 horas, y la masa de reacción se agitó durante 12 a 15 horas a 25-30 C. La masa resultante se filtró y se lavó con metiletilcetona (500 ml).La capa orgánica resultante se lavó con agua (500 ml) seguido de lavados con solución saturada de bicarbonato de sodio (500 ml) y solución de salmuera (500 ml).La capa orgánica resultante se destiló al vacío por debajo de 50ºC para dar para-toluenosulfonato de 2-(2-tienil)-etilo como una masa oleosa (Peso del aceite: 505 g; Pureza por HPLC: 97%). | |
| con carbonato de potasio;en tolueno;a 0 - 20 ℃;durante 3,5 horas; | A un matraz de reacción de 1000 ml se añadieron 500 ml de tolueno, 50 g de etanol de tiofeno y 80 g de cloruro de p-toluenosulfonilo, se encendió la agitación, se añadieron gota a gota a temperatura controlada 64 g de carbonato de potasio, se continuó la adición durante unos 30 min, goteo Se terminó de calentar la reacción a 20 °C durante 3 horas. A la solución de reacción se le añadieron 400 ml de agua. Se lavó dos veces. La capa de tolueno lavada se usó directamente para la siguiente reacción. | |
| con N-etil-N,N-diisopropilamina;en tolueno;a 0 - 20 ℃;durante 3,5 horas; | Se añadieron 500 ml de tolueno a un matraz de reacción de 1000 ml, 50 g de etanol de tiofeno y 92 g de cloruro de p-toluenosulfonilo, se agitó a 0 C, se añadieron 62 g de N,N-diisopropiletilamina durante aproximadamente 30 min.Cuando se completó el goteo, la mezcla se calentó a 20°C y se hizo reaccionar durante 3 horas.A la solución de reacción se añadieron 400 ml de agua, se lavó dos veces, la capa de tolueno lavada se usó directamente para la siguiente reacción. | |
| con trietilamina;en tolueno;a 0 - 20 ℃;por 3 horas; | En un matraz de reacción de 1000 ml se colocaron 500 ml de tolueno, 50 g de etanol de tiofeno y 80 g de cloruro de p-toluenosulfonilo y se elevó la temperatura a 20ºC durante 3 horas.Se añadieron 400 ml de agua a la solución de reacción, se lavó dos veces, se lavó con tolueno, la capa pasó directamente al siguiente paso de reacción. | |
| con carbonato de potasio;en tolueno;a 0 - 20 ℃;durante 3,5 horas; | En un matraz de reacción de 1000 ml se colocaron 500 ml de tolueno, 50 g de etanol de tiofeno y 107 g de cloruro de p-toluenosulfonilo, se encendió la agitación, se controló la temperatura a 0 C, se agregaron gota a gota 64 g de carbonato de potasio, la adición duró aproximadamente 30 min, después de lo cual se calentó a 20 C y se hizo reaccionar durante 3 horas, se añadieron 400 ml de agua a la solución de reacción, se lavó dos veces y la capa de tolueno lavada se usó directamente para la siguiente reacción. | |
| con trietilamina;en tolueno;a 0 - 25 ℃;durante 3,5 horas; | Ejemplo 1 El método de preparación de clorhidrato de ticlopidina como se muestra en la Fig. 2 comprende los siguientes pasos: 1.Protección de p-toluenosulfonilo: En un matraz de reacción de 1000 ml, se cargaron 500 ml de tolueno, 50 g de etanol de tiofeno y 80 g de cloruro de p-toluenosulfonilo y se agitó para control. A una temperatura de 0 C, se agregaron gota a gota 47 g de trietilamina, dejando caer durante aproximadamente 30 minutos y la temperatura se elevó a 25 C durante 3 horas. Agregue 400 ml de agua, lave dos veces, lave con una capa de tolueno directamente al siguiente paso de reacción.2.Reacción de condensación La solución de reacción de tolueno en el paso anterior se añadió a un matraz de reacción de 1000 ml, seguido de la adición de 114 g de o-clorobencilamina y calentamiento a 90 C durante 3 horas.Después de la reacción, la mezcla se enfrió a 25°C y se agitó durante 1 hora.Al filtrado se le agregaron 200 ml de agua, y ácido clorhídrico. Ajustar el pH del sistema a 8.5, estratificar la capa superior de tolueno y continuar gota a gota de ácido clorhídrico para ajustar el pH a 5, luego enfriar el sistema a 2 C. Se mezclaron los cristales por 4 horas y se filtró, y la torta del filtro se secó al vacío a 50°C para dar 96 g del clorhidrato condensado.3 ?Reacción en bucle cerrado Al matraz de reacción de 1000 ml se añadieron 96 g del clorhidrato condensado, 400 ml de 1,3-dioxano y 5 ml de ácido clorhídrico, a 90ºC durante 6 horas.Después de la reacción, la mezcla se enfrió a 7°C y se agitó durante 3 horas.La torta del filtro se lavó con una pequeña cantidad de 1,3-dioxetano. Después de un secado al vacío a 50 °C, se obtuvieron 95 g de clorhidrato de ticlopidina4 ?Refinado En un matraz de reacción de 1000 ml, se añadieron 95 g de clorhidrato de ticlopidina crudo y 500 ml de etanol absoluto y se calentó a 72 C con agitación, unos 10 minutos después se disuelve completamente el sólido añadiendo 2 g de carbón activado, blanqueando el aislamiento 20 minutos después de la filtro caliente, enfriando gradualmente el filtrado. Los cristales se cristalizaron a 4ºC durante 4 horas y se filtraron.La torta del filtro se lavó con una pequeña cantidad de etanol absoluto y se secó al vacío a 50 °C para dar 91 g de productos de precisión de clorhidrato de titiol.Rendimiento total 82%, pureza 99,9% | |
| con hidróxido de sodio;En agua;tolueno;a 10 - 55 ℃;por 11h; | En un matraz de tres bocas se colocaron 97 g de cloruro de p-toluenosulfonilo y 180 ml de tolueno. Se agitó y disolvió, se filtró, se mantuvo caliente a 15-20 C, se colocaron 60 g de 2-tiofenetanol y 60 ml de tolueno en un matraz de tres bocas. 120 g de hidróxido de sodio acuoso al 40 %, agitando. se calienta a 45-55 C durante 8 hy se deja reposar para la estratificación. La fase orgánica se despresuriza para eliminar el tolueno para dar p-toluenosulfonato de 2-(2-tiofeno)etanol.Aceite de color pardo rojizo;la fórmula molecular es la siguiente: | |
| 235,1g | con hidróxido de sodio;en cloroformo;a 0 - 5 ℃;por 12h; | Al matraz de reacción, el paso anterior 2-tiofeno etanol: 112 g, cloroformo 600 g, PTSC 249,4 g, y la mezcla se enfrió a 0-5 C. Agregar 834 g de solución de hidróxido de sodio al 10 % en masa, controlar la temperatura 0 -5 C, mantener caliente durante 12 h, agregar ácido clorhídrico a pH=12, capa, la capa de agua se extrae con 300 g de cloroformo y la capa de cloroformo se combina.Después de lavar con 100 g de agua, la capa orgánica se destiló hasta sequedad para dar p-toluenosulfonato de 2-tiofenetanol: 235,1 g rendimiento 95,3%, pureza 99,5%. |
Escribe aquí tu mensaje y envíanoslo

![[ N.º CAS 5402-55-1 ] 2-tiofenoetanol Imagen destacada](https://www.ohlsenwin.com/uploads/p1.png)
![[ N.º CAS 5402-55-1 ] 2-tiofenoetanol](https://www.ohlsenwin.com/uploads/p1-300x300.png)
![[ N.º CAS 5402-55-1 ] 2-tiofenoetanol](https://www.ohlsenwin.com/uploads/product-2-300x300.png)
![[ N.º CAS 5402-55-1 ] 2-tiofenoetanol](https://www.ohlsenwin.com/uploads/product-1-300x300.png)





![[ N.° CAS 141109-14-0 ] (S)-metil 2-amino-2-(2-clorofenil)acetato](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-2-300x300.png)
![[ N.º CAS 141109-19-5 ] Clorhidrato de (S)-metil 2-(2-clorofenil)-2-((2-(tiofen-2-il)etil)amino)acetato](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-31-300x300.png)
![[N.º CAS 40412-06-4] 4-metilbencenosulfonato de 2-(tiofeno-2-il)etilo](https://www.ohlsenwin.com/uploads/ethanol-Tosylate-4-300x300.png)