[ CAS No. 5402-55-1 ] 2-チオフェンエタノール
製品規格
| 外観 | 無色〜淡黄色透明の液体 |
| アイデンティティテスト | 保持時間は GC による参照に準拠 |
| 純度 | 99%以上(GC)) |
| 3-チオプネンエタノール | 0.1%以下(GC) |
| 個々の不純物 (知らない) | 0.2%以下(GC) |
| 含水量 | 0.3%以下(W/W) |
| 再試験期間 | 1年 |
[ 5402-55-1 ] の商品詳細
| CAS番号: | 5402-55-1 | MDL番号: | MFCD00005462 |
| 方式 : | C6H8OS | 沸点 : | 760mmHgで223℃ |
| 線形構造式 : | - | InChI キー: | なし |
| 分子量: | 128.19グラム/モル | パブリッケム ID : | 79400 |
| 同義語 : | |||
[ 5402-55-1 ] の化学計算結果
物理化学的性質
| うーん。重原子 : | 8 |
| うーん。あろむ。重原子 : | 5 |
| フラクション Csp3 : | 0.33 |
| うーん。回転可能な結合: | 2 |
| うーん。水素結合アクセプター: | 1.0 |
| うーん。水素結合供与体: | 1.0 |
| モル屈折率: | 35.25 |
| TPSA : | 48.47Ų |
薬物動態
| GI吸収: | 高い |
| BBB浸透性: | はい |
| P-gp基質: | No |
| CYP1A2阻害剤: | No |
| CYP2C19阻害剤: | No |
| CYP2C9阻害剤: | No |
| CYP2D6阻害剤: | No |
| CYP3A4阻害剤: | No |
| Log Kp (皮膚透過性) : | -6.18cm/秒 |
親油性
| ログ Po/W (iLOGP): | 1.75 |
| ログ Po/W (XLOGP3) : | 1.27 |
| ログ Po/W (WLOGP) : | 1.28 |
| ログPo/w (MLOGP): | 0.84 |
| ログPo/w (SILICOS-IT): | 2.67 |
| コンセンサスログのPo/w: | 1.56 |
ドラッグライクネス
| リピンスキー : | 0.0 |
| ゴース: | なし |
| ヴェーバー : | 0.0 |
| イーガン: | 0.0 |
| ムエッゲ : | 1.0 |
| バイオアベイラビリティスコア: | 0.55 |
水溶性
| ログ S (ESOL) : | -1.77 |
| 溶解度 : | 2.2mg/ml;0.0172モル/リットル |
| クラス : | 非常に溶けやすい |
| ログS(アリ): | -1.89 |
| 溶解度 : | 1.66 mg/ml ;0.013モル/リットル |
| クラス : | 非常に溶けやすい |
| ログ S (SILICOS-IT) : | -1.86 |
| 溶解度 : | 1.77 mg/ml ;0.0138モル/リットル |
| クラス : | 可溶性 |
創薬化学
| 痛み : | 0.0 アラート |
| ブレンク: | 0.0 アラート |
| 鉛らしさ : | 1.0 |
| 総合的なアクセシビリティ: | 1.82 |
[ 5402-55-1 ] の安全性
| 合言葉: | 警告 | クラス: | なし |
| 注意事項: | P261-P305+P351+P338 | 国連#: | なし |
| 危険有害性情報: | H302-H315-H319-H335 | 梱包グループ: | なし |
| GHS ピクトグラム: |  | ||
注意事項 - 全般
| コード | 段階 |
| P101 | 医師のアドバイスが必要な場合は、製品の容器またはラベルを手元に用意してください。 |
| P102 | 小児の手の届かない場所に保管。 |
| P103 | 使用前にラベルを読んでください |
防止
| コード | 段階 |
| P201 | 使用前に特別な指示を得てください。 |
| P202 | すべての安全上の注意事項を読んで理解するまでは扱わないでください。 |
| P210 | 熱/火花/裸火/高温の表面から遠ざけてください。- 喫煙禁止。 |
| P211 | 裸火やその他の着火源にスプレーしないでください。 |
| P220 | 衣服や可燃物から遠ざけて保管してください。 |
| P221 | 可燃物との混合を避けるためにあらゆる予防措置を講じてください |
| P222 | 空気に触れさせないでください。 |
| P223 | 激しい反応やフラッシュ火災の可能性があるため、水との接触を避けてください。 |
| P230 | 濡れたままにしておく |
| P231 | 不活性ガス下で取り扱ってください。 |
| P232 | 湿気から守ります。 |
| P233 | 容器は密閉して保管してください。 |
| P234 | 元の容器にのみ保管してください。 |
| P235 | 冷静さを保つ |
| P240 | コンテナと受け取り装置を接地/接着します。 |
| P241 | 防爆型の電気/換気/照明/機器を使用してください。 |
| P242 | 火花が出ない工具のみを使用してください。 |
| P243 | 静電気放電に対する予防措置を講じてください。 |
| P244 | 減圧弁にはグリースやオイルが付着しないようにしてください。 |
| P250 | 研磨・衝撃・摩擦を与えないでください。 |
| P251 | 加圧容器:使用後であっても、穴を開けたり、燃やしたりしないでください。 |
| P260 | 粉塵、ヒューム、ガス、ミスト、蒸気、スプレーを吸入しないでください。 |
| P261 | 粉塵、ヒューム、ガス、ミスト、蒸気、スプレーを吸入しないようにしてください。 |
| P262 | 目に入ったり、皮膚や衣類に付着しないように注意してください。 |
| P263 | 妊娠中/授乳中は接触を避けてください。 |
| P264 | 取り扱い後は手をよく洗ってください。 |
| P265 | 取り扱い後は皮膚をよく洗ってください。 |
| P270 | この製品を使用するときは、飲食または喫煙しないでください。 |
| P271 | 屋外または換気の良い場所でのみ使用してください。 |
| P272 | 汚染された作業服は職場の外に持ち出すべきではありません。 |
| P273 | 環境への放出を避けてください。 |
| P280 | 保護手袋/保護服/保護眼鏡/保護面を着用してください。 |
| P281 | 必要に応じて個人用保護具を使用してください。 |
| P282 | 防寒手袋・フェイスシールド・保護メガネを着用してください。 |
| P283 | 防火/難燃性/難燃性の衣服を着用してください。 |
| P284 | 呼吸用保護具を着用してください。 |
| P285 | 換気が不十分な場合は、呼吸用保護具を着用してください。 |
| P231 + P232 | 不活性ガス下で取り扱ってください。湿気から守ります。 |
| P235 + P410 | 冷静さを保つ。日光から保護してください。 |
応答
| コード | 段階 |
| P301 | 飲み込んだ場合: |
| P304 | 吸入した場合: |
| P305 | 目に入った場合: |
| P306 | 衣服についた場合: |
| P307 | 暴露された場合: |
| P308 | 暴露または懸念がある場合: |
| P309 | 感染した場合、または気分が悪くなった場合: |
| P310 | すぐに中毒センターまたは医師/医師に連絡してください。 |
| P311 | 中毒センターまたは医師/医師に連絡してください。 |
| P312 | 気分が悪くなった場合は、中毒センターまたは医師に連絡してください。 |
| P313 | 医師のアドバイス/手当てを受けてください。 |
| P314 | 気分が悪い場合は、医師の診断/手当てを受けてください。 |
| P315 | 直ちに医師の診断/手当てを受けてください。 |
| P320 | |
| P302 + P352 | 皮膚に付着した場合:多量の石鹸と水で洗い流してください。 |
| P321 | |
| P322 | |
| P330 | 含嗽。 |
| P331 | 嘔吐させないでください。 |
| P332 | 皮膚に炎症が起きた場合: |
| P333 | 皮膚の炎症や発疹が発生した場合: |
| P334 | 冷水に浸す/濡れた包帯を巻く。 |
| P335 | 皮膚から浮いた粒子をブラシで取り除きます。 |
| P336 | 曇った部分はぬるま湯で解凍してください。患部をこすらないでください。 |
| P337 | 目の炎症が続く場合: |
| P338 | コンタクトレンズがあれば、それが簡単に外せます。すすぎを続けます。 |
| P340 | 傷病者を新鮮な空気の場所に移し、呼吸しやすい姿勢で安静にさせてください。 |
| P341 | 呼吸が困難な場合は、被害者を新鮮な空気の場所に移し、呼吸しやすい姿勢で休ませてください。 |
| P342 | 呼吸器症状がある場合: |
| P350 | 多量の石鹸と水で優しく洗ってください。 |
| P351 | 水で数分間注意深く洗い流してください。 |
| P352 | 多量の石鹸と水で洗ってください。 |
| P353 | 水/シャワーで皮膚を洗い流してください。 |
| P360 | 汚染された衣類と皮膚を直ちに多量の水で洗い流してから、衣類を脱いでください。 |
| P361 | 汚染された衣類をすべて直ちに脱いでください。 |
| P362 | 汚染された衣類を脱いで、再使用する前に洗濯してください。 |
| P363 | 汚染された衣類は、再使用する前に洗濯してください。 |
| P370 | 火災の場合: |
| P371 | 大規模な火災と大量の場合: |
| P372 | 火災時の爆発の危険。 |
| P373 | 火が爆発物に達したときは、消火活動をしないでください。 |
| P374 | 適切な距離から通常の予防措置を講じて消火してください。 |
| P376 | 安全に行える場合は、漏れを止めてください。酸化性ガス (セクション 2.4) 1 |
| P377 | ガス漏れ火災: 漏れを安全に止めることができない限り、消火しないでください。 |
| P378 | |
| P380 | エリアを避難してください。 |
| P381 | 安全に行える場合は、すべての着火源を取り除きます。 |
| P390 | 材料の損傷を防ぐためにこぼれたものを吸収します。 |
| P391 | 流出物を回収します。水生環境に有害 |
| P301 + P310 | 飲み込んだ場合: 直ちに中毒センターまたは医師に連絡してください。 |
| P301 + P312 | 飲み込んだ場合: 気分が悪くなった場合は、中毒センターまたは医師に連絡してください。 |
| P301 + P330 + P331 | 飲み込んだ場合: 口をすすぐ。嘔吐させないでください。 |
| P302 + P334 | 皮膚についた場合: 冷水に浸すか、濡れた包帯で巻いてください。 |
| P302 + P350 | 皮膚に付着した場合: 多量の石鹸と水で優しく洗ってください。 |
| P303 + P361 + P353 | 皮膚 (または髪) に付着した場合: 汚染された衣服をすべて直ちに脱いでください。水/シャワーで肌を洗い流してください。 |
| P304 + P312 | 吸入した場合: 気分が悪くなった場合は、中毒センターまたは医師に連絡してください。 |
| P304 + P340 | 吸入した場合: 傷病者を新鮮な空気の場所に移し、呼吸しやすい姿勢で安静にさせてください。 |
| P304 + P341 | 吸入した場合: 呼吸が困難な場合は、被害者を新鮮な空気の場所に移し、呼吸しやすい姿勢で休ませてください。 |
| P305 + P351 + P338 | 目に入った場合: 水で数分間注意深く洗い流してください。コンタクトレンズがあれば、それが簡単に外せます。すすぎを続けます。 |
| P306 + P360 | 衣服に付着した場合: 衣服を脱ぐ前に、汚染された衣服と皮膚を直ちに多量の水で洗い流してください。 |
| P307 + P311 | 暴露した場合: 中毒センターまたは医師/医師に連絡してください。 |
| P308 + P313 | 暴露または懸念がある場合: 医師のアドバイス/手当てを受けてください。 |
| P309 + P311 | 暴露した場合、または気分が悪くなった場合: 中毒センターまたは医師/医師に連絡してください。 |
| P332 + P313 | 皮膚の炎症が起こった場合: 医師の診断/手当を受けてください。 |
| P333 + P313 | 皮膚の炎症や発疹が発生した場合: 医師の診断/手当てを受けてください。 |
| P335 + P334 | 皮膚から浮いた粒子をブラシで取り除きます。冷水に浸す/湿った包帯を巻く。 |
| P337 + P313 | 目の炎症が続く場合: 医師のアドバイス/診察を受けてください。 |
| P342 + P311 | 呼吸器症状がある場合: 中毒センターまたは医師/医師に連絡してください。 |
| P370 + P376 | 火災の場合: 安全であれば漏れを止めてください。 |
| P370 + P378 | 火災の場合: |
| P370 + P380 | 火災の場合: エリアから避難してください。 |
| P370 + P380 + P375 | 火災の場合: エリアから避難してください。爆発の危険があるため、遠隔から消火してください。 |
| P371 + P380 + P375 | 大火災および大量の火災の場合: エリアから避難してください。爆発の危険があるため、遠隔から消火してください。 |
保管所
| コード | 段階 |
| P401 | |
| P402 | 乾燥した場所に保管してください。 |
| P403 | 換気の良い場所に保管してください。 |
| P404 | 密閉容器に保管してください。 |
| P405 | 施錠して保管してください。 |
| P406 | 耐食性/耐食性インナーライナー付きの容器に保管してください。 |
| P407 | スタック/パレット間のエアギャップを維持します。 |
| P410 | 日光から保護してください。 |
| P411 | |
| P412 | 50 °C/122 °F を超える温度にさらさないでください。 |
| P413 | |
| P420 | 他の物質から離して保管してください。 |
| P422 | |
| P402 + P404 | 乾燥した場所に保管してください。密閉容器に保管してください。 |
| P403 + P233 | 換気の良い場所に保管してください。容器は密閉して保管してください。 |
| P403 + P235 | 換気の良い場所に保管してください。冷静さを保つ。 |
| P410 + P403 | 日光から保護してください。換気の良い場所に保管してください。 |
| P410 + P412 | 日光から保護してください。50 oC/122oF を超える温度にさらさないでください。 |
| P411 + P235 | 冷静さを保つ。 |
廃棄
| コード | 段階 |
| P501 | 内容物/容器は次の場所に廃棄してください。 |
| P502 | 回収/リサイクルについてはメーカー/サプライヤーにお問い合わせください。 |
物理的危険性
| コード | 段階 |
| H200 | 不安定な爆発物 |
| H201 | 爆発性。大量爆発の危険性 |
| H202 | 爆発性。重大な投影の危険性 |
| H203 | 爆発性。火災、爆発、または投射の危険性 |
| H204 | 火災または投影の危険性 |
| H205 | 火災による大量爆発の可能性がある |
| H220 | 非常に引火性の高いガス |
| H221 | 可燃性ガス |
| H222 | 非常に引火性の高いエアロゾル |
| H223 | 可燃性エアロゾル |
| H224 | 非常に引火性の高い液体および蒸気 |
| H225 | 引火性の高い液体および蒸気 |
| H226 | 引火性の液体および蒸気 |
| H227 | 可燃性液体 |
| H228 | 可燃性固体 |
| H229 | 加圧容器: 加熱すると破裂する可能性があります |
| H230 | 空気が存在しない場合でも爆発的に反応する可能性がある |
| H231 | 高圧および/または高温では空気が存在しない場合でも爆発的に反応する可能性がある |
| H240 | 加熱すると爆発を引き起こす可能性がある |
| H241 | 加熱すると火災や爆発の原因となる可能性があります |
| H242 | 加熱すると火災の原因となることがあります |
| H250 | 空気に触れると自然発火する |
| H251 | 自己発熱。発火する可能性があります |
| H252 | 大量に自己発熱する。発火する可能性があります |
| H260 | 水と接触すると可燃性ガスが発生し、自然発火する可能性があります |
| H261 | 水と接触すると可燃性ガスが発生する |
| H270 | 火災を引き起こしたり、火災を悪化させたりする可能性があります。酸化剤 |
| H271 | 火災や爆発の原因となる可能性があります。強力な酸化剤 |
| H272 | 火災が激化する可能性があります。酸化剤 |
| H280 | 加圧されたガスが含まれています。加熱すると爆発する可能性がある |
| H281 | 冷蔵ガスが含まれています。極低温火傷や怪我を引き起こす可能性があります |
| H290 | 金属を腐食する可能性がある |
健康被害
| コード | 段階 |
| H300 | 飲み込むと致命的 |
| H301 | 飲み込むと有毒 |
| H302 | 飲み込むと有害 |
| H303 | 飲み込むと有害な可能性があります |
| H304 | 飲み込んで気道に入ると死亡する可能性がある |
| H305 | 飲み込んで気道に入ると有害の可能性がある |
| H310 | 皮膚に接触すると致命的 |
| H311 | 皮膚に接触すると有毒 |
| H312 | 皮膚に接触すると有害 |
| H313 | 皮膚に接触すると有害な可能性がある |
| H314 | 重度の皮膚の火傷や目の損傷を引き起こす |
| H315 | 皮膚の炎症を引き起こす |
| H316 | 軽度の皮膚刺激を引き起こす |
| H317 | アレルギー性皮膚反応を引き起こす可能性がある |
| H318 | 目に重大な損傷を引き起こす |
| H319 | 重度の目の炎症を引き起こす |
| H320 | 目の炎症を引き起こす |
| H330 | 吸い込むと致命的 |
| H331 | 吸入すると有毒 |
| H332 | 吸入すると有害 |
| H333 | 吸入すると有害の可能性がある |
| H334 | 吸入するとアレルギーや喘息の症状、呼吸困難を引き起こす可能性があります |
| H335 | 呼吸器への刺激を引き起こす可能性がある |
| H336 | 眠気やめまいを引き起こす可能性がある |
| H340 | 遺伝的欠陥を引き起こす可能性がある |
| H341 | 遺伝的欠陥を引き起こす疑いがある |
| H350 | がんを引き起こす可能性がある |
| H351 | がんを引き起こす疑いがある |
| H360 | 生殖能力や胎児にダメージを与える可能性がある |
| H361 | 生殖能力または胎児に悪影響を与える疑いがある |
| H361d | 胎児に危害を加えた疑い |
| H362 | 母乳で育てられた子供に害を及ぼす可能性があります |
| H370 | 臓器にダメージを与える |
| H371 | 臓器に損傷を与える可能性があります |
| H372 | 長期または反復暴露により臓器に損傷を引き起こす |
| H373 | 長期または反復暴露により臓器に損傷を引き起こす可能性がある |
環境上の危険性
| コード | 段階 |
| H400 | 水生生物に対して非常に有毒 |
| H401 | 水生生物に対して有毒 |
| H402 | 水生生物に有害 |
| H410 | 水生生物に対して非常に有毒で、長期にわたる影響を及ぼします。 |
| H411 | 水生生物に対して有毒であり、長期にわたる影響を与える |
| H412 | 長期にわたる影響で水生生物に有害 |
| H413 | 水生生物に長期にわたる悪影響を及ぼす可能性がある |
| H420 | 大気上層部のオゾンを破壊することで公衆衛生と環境に悪影響を与える |
[ 5402-55-1 ] の合成への応用
[5402-55-1]の上流合成ルート
[ 5402-55-1 ]の下流合成ルート
[5402-55-1]の上流合成ルート
| 収率 | 反応条件 | 実験中の動作 |
|---|---|---|
| 72% | 接合菌真菌 S の株を使用.racemosum MUT 770 ジメチルスルホキシド中で 72 時間。酵素反応 | 2.3.生体内変化実験 菌株は、マルテキストラクト固体培地 (MEA: 20 g L-1 グルコース、20 g L-1 麦芽抽出物、20 g L-1 寒天、2 g L-1 ペプトン) を含むペトリ皿で事前に増殖させました。液体培養用が設置されました。この真菌を、40mLのマルテクストラクト液体培地を含む50mLのアスク中の分生子懸濁液(1×106分生子/mL)として接種した。フラスコを25℃でインキュベートし、撹拌下(110rpm)で維持した。2日間の予備増殖後、DMSO中の基質の500mM溶液を、1~5mMの開始基質濃度(c0)まで添加した。基質ごとに、3 つの生物学的複製を実行しました。実験は、基質の添加後 3 日間実行し、その間に 1 mL のサンプルを特定の間隔 (通常は 24、48、および 72 時間) で採取しました。各サンプルをEtOAc(500L)で抽出し、有機相を無水Na2SO4で乾燥させ、GC/MSによって分析した。場合によっては (セクション 2.4 を参照)、還元された生成物の分離が行われます。生体内変換の各セットについて、基質を添加する前の初期バイオマスと pH を測定するために 1 つの質問が使用されました。実験の終了時にすべての質問に対して評価されます。液体培地を濾過によってバイオマスから分離し、pH測定に使用し、菌糸体を60℃で24時間乾燥させてバイオマスの乾燥重量を測定した。2-(チオフェン-2-イル)エタノール: 2-(チオフェン-2-イル)酢酸(3.7 mg、72パーセント)および2-(チオフェン-2-イル)酢酸メチル(24.6 mg、96パーセント)から。1H NMR (400 MHz、CDCl3、TMS): = 7.20 (m、1H、複素芳香族水素)、6.99 (m、1H、複素芳香族水素)、6.90 (m、1H、複素芳香族水素)、3.85 (t、2H、 J = 6.2 Hz、CH2OH)、3.02(t、2H、J = 6.2 Hz、CH2CH2OH)。13C NMR(100MHz、CDCl3、TMS):=140.5、127.0、125.8、124.0、63.4、33.3。GC/MS: tR = 9.47 分、m/z128 (M+, 30)、110 (5)、97 (100) |
| 66.5% | ステージ #1: テトラヒドロフラン中、0 ~ 20℃で四水素化リチウム アルミニウムを使用。 ステージ #2: 水あり。塩化ナトリウム テトラヒドロフラン中、0℃。 | ステップ 9 2-(チオフェン-2-イル)エタノール: 約0℃で、テトラヒドロフラン(10mL)中のチオフェン-2-イル-酢酸(1.0g;7.03mmol)の溶液を、水素化アルミニウムリチウム(0.534g;14.05mmol)の乾燥懸濁液に滴下した。テトラヒドロフラン(10mL)。 混合物を周囲温度で約4時間撹拌し、次いで約0℃に冷却した。 冷飽和塩化ナトリウム溶液(1mL)を加えた後、混合物を濾過し、無機塩をテトラヒドロフランおよび酢酸エチルで洗浄した。 濾液と洗浄液を合わせ、真空で濃縮して、表題化合物を褐色の油として得た(0.600 g; 66.5パーセント)。 1H NMR (400 MHz、CDCl)3) δ 1.60 (br、Dと交換可能)2O, 1H), 3.08 (t, J=6.2 Hz, 2H), 3.85 (t, J=6.2 Hz, 2H), 6.87-6.88 (m, 1H), 6.95-6.97 (m, 1H), 7.16-7.25 (m、1H)。IR (フィルム) υ 3345, 3105, 2211, 2126, 2090, 1792, 1433, 1138, 972, 737, 699 cm-1MS: 129 (M+1)。 |
| 収率 | 反応条件 | 実験中の動作 |
|---|---|---|
| 96% | 接合菌真菌 S の株を使用.racemosum MUT 770 ジメチルスルホキシド中で 72 時間。酵素反応 | 2.3.生体内変化実験 菌株は、マルテキストラクト固体培地 (MEA: 20 g L-1 グルコース、20 g L-1 麦芽抽出物、20 g L-1 寒天、2 g L-1 ペプトン) を含むペトリ皿で事前に増殖させました。液体培養用が設置されました。この真菌を、40mLのマルテクストラクト液体培地を含む50mLのアスク中の分生子懸濁液(1×106分生子/mL)として接種した。フラスコを25℃でインキュベートし、撹拌下(110rpm)で維持した。2日間の予備増殖後、DMSO中の基質の500mM溶液を、1~5mMの開始基質濃度(c0)まで添加した。基質ごとに、3 つの生物学的複製を実行しました。実験は、基質の添加後 3 日間実行し、その間に 1 mL のサンプルを特定の間隔 (通常は 24、48、および 72 時間) で採取しました。各サンプルをEtOAc(500L)で抽出し、有機相を無水Na2SO4で乾燥させ、GC/MSによって分析した。場合によっては (セクション 2.4 を参照)、還元された生成物の分離が行われます。生体内変換の各セットについて、基質を添加する前の初期バイオマスと pH を測定するために 1 つの質問が使用されました。実験の終了時にすべての質問に対して評価されます。液体培地を濾過によってバイオマスから分離し、pH測定に使用し、菌糸体を60℃で24時間乾燥させてバイオマスの乾燥重量を測定した。2-(チオフェン-2-イル)エタノール: 2-(チオフェン-2-イル)酢酸(3.7 mg、72パーセント)および2-(チオフェン-2-イル)酢酸メチル(24.6 mg、96パーセント)から。1H NMR (400 MHz、CDCl3、TMS): = 7.20 (m、1H、複素芳香族水素)、6.99 (m、1H、複素芳香族水素)、6.90 (m、1H、複素芳香族水素)、3.85 (t、2H、 J = 6.2 Hz、CH2OH)、3.02(t、2H、J = 6.2 Hz、CH2CH2OH)。13C NMR(100MHz、CDCl3、TMS):=140.5、127.0、125.8、124.0、63.4、33.3。GC/MS: tR = 9.47 分、m/z128 (M+, 30)、110 (5)、97 (100) |
[ 5402-55-1 ]の下流合成ルート
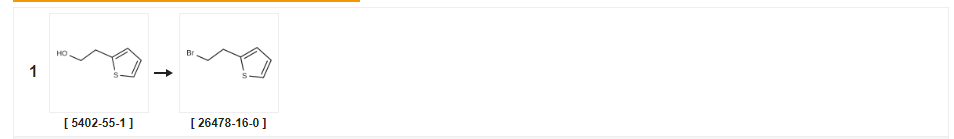
| 収率 | 反応条件 | 実験中の動作 |
|---|---|---|
| 94% | 四臭化炭素を使用すると、トリフェニルホスフィン テトラヒドロフラン中、0℃;シュレンク技術。不活性雰囲気; | |
| 69% | 臭素を使用すると、トリフェニルホスフィン ジクロロメタン中、20℃。 | |
| 64% | P.31 2-(2-ブロモエチル)チオフェンの合成 製造例31 2-(2-ブロモエチル)チオフェンの合成 2-チエニルエタノール(0.44ml)を上記製造例1と同様に処理して、表題化合物(0.490g)を無色油状物として得た(収率64.0%)。1H-NMR (400 MHz, CDCl3): δ(ppm) 3.38(2H, t, J=7.6Hz), 3.58(2H, t, J=7.6Hz), 6.89(1H, d, J=1.2Hz), 6.96(1H、d、J=4.2Hz)、7.19(1H、dd、J=1.2、4.2Hz)。 |
| 28% | 三臭化リンの場合、ジクロロメタン中、0 ~ 20℃。1時間。 | |
| 19% | 三臭化リンを使用、テトラクロロメタン中、65℃。0.333333時間。 | a 三臭化リン(2.0mL、21.1mmol)を、四塩化炭素(162mL)中の2-(チオフェン-2-イル)エタノール(2.25g、17.6mmol)の撹拌溶液に添加し、次いで混合物を65℃で3時間加熱した。 20分。混合物を周囲温度まで放冷し、次いで氷を加えた。有機層を分離し、次いで水層をジクロロメタン(2×30mL)で抽出した。合わせた有機層をブラインで洗浄し、次いで乾燥させ(NaSO4)、濾過し、真空中で減量した。残留物を、酢酸エチル:ヘキサン混合物0:100から0.5:95.5で溶出するシリカ上のフラッシュクロマトグラフィーにより精製して、2-(2-ブロモエチル)チオフェンを褐色油として得た(650mg、19%)。 |
| ピリジンを使用すると、クロロホルム;三臭化リン | ||
| 三臭化リンを使用、ジエチルエーテル中、0℃。4時間。 | 2D 例 2D;9-(4,5-ジメチル-チアゾール-2-イル)-4-[4-(2-チオフェン-2-イル-エチル)-ピペラジン-1-イル]-5,6,7,8-テトラヒドロ- 1, 3, 4B-トリアザ-フルオレン 2−(2−チエニル)エタノール(1.63g)の乾燥エーテル(15mL)中溶液に0℃でPBr3(1.31mL)を滴下した。4時間後、反応混合物をジクロロメタンで希釈し、水で洗浄し、乾燥させ(MGSO4)、溶媒を真空で除去して茶色の油を得、これをフラッシュクロマトグラフィーを使用して精製して2-(2-ブロモ-エチル)-チオフェンを得た。9-(4,5-ジメチル-チアゾール-2-イル)-4-ピペラジン-1-イル-5,6,7,8-テトラヒドロ-1,3,4b-トリアザ-フルオレン(85mg)の混合物、 2-(2-ブロモ-エチル)-チオフェン(44mg)および炭酸カリウム(38mg)をアセトニトリル(5ML)中で4時間加熱還流した。反応混合物を冷却し、ジクロロメタンに抽出し、乾燥させ(MGS04)、溶媒を真空中で除去して粗生成物を得、これをフラッシュクロマトグラフィーを用いて精製して表題化合物(30mg)を得た。 |
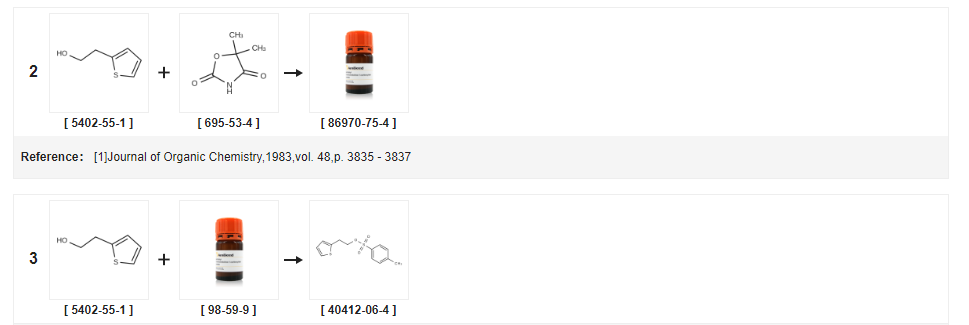
| 収率 | 反応条件 | 実験中の動作 |
|---|---|---|
| 98% | トリエチルアミンを使用すると、35℃、氷で冷やす。 | 1L三口フラスコに2−チオフェンエタノール(0.87モル)、塩化p−トルエンスルホニル184g(0.97モル)を順次加え、氷水浴下でトリエチルアミン98g(0.97モル)を滴下し、反応液の温度を20℃以下に保ち、滴下を終了し、35℃に加熱して撹拌を続け、それぞれ24時間、27時間サンプリング、TLC、反応が完了するまで反応を停止し、濾過し、適切なフィルターでケーキを濾過する。塩化メチレン層を無水硫酸ナトリウムで2時間乾燥した。乾燥剤を濾別し、乾燥剤を少量の塩化メチレンで洗浄した。濾液を真空中で減圧し、濾液を減圧下で蒸発させた。一定重量まで濃縮すると茶色の油状物が得られ、重量は 203g、収率は 98%、 |
| 96.37% | トリエチルアミンを使用すると、トルエン中で;5~30℃。20.8333 時間;生成物の分布/選択性; | 実施例3 トルエンを使用したパラ−トルエンスルホン酸2−チエニルエチル(式VII)の製造 400リットルのトルエンおよび163.2kgのパラ−トルエンスルホニルクロリドを清潔な乾燥反応器に装入し、続いて約5℃に冷却した。 2-エタノールを約5℃で約20分かけて添加し、続いてトリエチルアミン130kgを約8時間50分かけて添加した。反応混合物の温度を約30℃に上げ、続いて約12時間撹拌した。反応塊をヌッチェフィルターを通して濾過し、2×100リットルのトルエンで洗浄した。反応濾液を別の反応器に移し、続いて5×200リットルの水で洗浄した。有機層と水層を分離し、有機層を真空下約70℃未満で完全に蒸留して、212kg(収率:96.37%)の表題化合物を得た。GCによる純度: 95.59%。 |
| 96.5% | トリエチルアミンを使用すると、ジクロロメタン中;-5〜20℃。2時間。 | 32.7g(0.17モル)のp−トルエンスルホニルクロリド、40mlのジクロロメタンを反応フラスコに入れ、−5℃に冷却し、20g(0.16モル)の2−チオフェンエタノール。28.4g(0.28モル)のトリエチルアミンをゆっくりと滴下し、そして反応溶液の温度を約0℃に維持した。反応物を室温まで温めた後、Biを加えて2時間インキュベートした。原料の2-チオフェンエタノールがなくなるまで吸引濾過し、固体を少量の塩化メチレンで洗浄し、濾液を飽和重曹水50mlで洗浄し、無水硫酸ナトリウムで乾燥した。濾過し、濾液を濃縮すると、薄茶色の固体が析出し、濾過し、少量の石油エーテルで白色になるまで洗浄した。すなわち、P-トルエンスルホン酸-2-チオフェンエチルエステル42.5g、収率96.5%(HPLC純度99%) |
| 95.5% | トリエチルアミンを使用すると、ジクロロメタン中;7.5~22.5℃。5時間;生成物分布/選択性; | 実施例10 ジクロロメタンを使用した2−(2−チオフェン)エタノールトシラート(式VII)の製造 4リットルのジクロロメタンを約30℃の温度で反応器に加え、約7.5℃の温度に冷却し、次いでその温度まで冷却した。 p-トルエンスルホニルクロリド1.784kg、続いてチオフェン-2-エタノール1kgを添加した。トリエチルアミン1.302kgを上記の反応塊に約7.5℃の温度で添加し、続いて反応塊の温度を約5時間かけて22.5℃までゆっくりと上昇させた。得られた反応塊を加圧ヌッチェフィルターで濾過し、塩化メチレン(2×1リットル)で洗浄し、母液を集めて別の反応器に移した。有機層を水(5×2リットル)で洗浄した。このようにして得られた有機層を、熱水循環を使用して70℃未満の温度で蒸留にかけた。得られた残渣を約30℃まで冷却し、2.1kg(収率:95.5%)の表題化合物を得た。 |
| 93.6% | トリエチルアミンを使用すると、トルエン中で;45℃で。4時間。 | 例1 0.2.(S)-1,2,3,4-テトラヒドロ-5-ヒドロキシ-N-プロピル-ナフタレン-2-アンモニウム臭化水素酸塩(VIII)のロチゴチン塩酸塩への変換;10.2.1.2-(2-チエニル)エチル-4-トルエンスルホネートの調製;4−トルエンスルホニルクロリド(162g)、トルエン(363.3g)および2−(2−チエニル)エタノール(104g)を混合する。温度を45℃未満に維持しながらトリエチルアミン(93g)を添加する。4時間後、混合物をリン酸水溶液、水酸化ナトリウム水溶液、次いで水で洗浄する。有機相を真空下で留去する。イソプロパノール(314g)およびヘプタン(365.9g)を添加する。バッチを冷却により結晶化し、−15℃で単離する。結晶を濾過し、ヘプタン(175mL)で洗浄する。次いで、>30℃の融点が得られるまで、結晶を真空下、室温で乾燥させる。収量(214g):93.6% HPLC分析により、>99%の純度が確認され、参照標準と比較して100%のアッセイが確認された。 |
| 93.6% | トリエチルアミンを使用すると、トルエン中で;45℃で。4時間。 | 4−トルエンスルホニルクロリド(162g)、トルエン(363.3g)および2−(2−チエニル)エタノール(104g)を混合する。温度を45℃未満に保ちながらトリエチルアミン(93g)を添加する。4時間後、混合物をリン酸水溶液、水酸化ナトリウム水溶液、次いで水で洗浄する。有機相を真空下で留去する。イソプロパノール(314g)およびヘプタン(365.9g)を添加する。バッチを冷却により結晶化し、−15℃で単離する。結晶を濾過し、ヘプタン(175mL)で洗浄する。次に結晶を真空下、室温で30℃の融点が得られるまで乾燥させる。収量(214g):93.6% |
| 90% | シリカゲル付き。ジクロロメタン中;2時間;還流; | 12.8g(0.1モル)の2−(2−チエニル)エタノール、1000mLのジクロロメタン、21.0g(0.12モル)のp−トルエンスルホン酸クロリドおよび10.0gのシリカゲルを反応フラスコに加え、反応物を2時間還流させ、冷却し、濾過してシリカゲルを除去した。反応混合物を蒸留水、飽和炭酸ナトリウム溶液、ブラインで順次洗浄し、次いで塩化メチレン溶媒を減圧蒸留により除去して、26.0gのp-トルエンスルホン酸を得た。 - (2-チエニル) エチル エステル、収率 90%。 |
| ピリジン中;水; | (a) 2-(2-ヒドロキシエチル)チオフェン トシラート トルエン-4-スルホニル クロリド (4.125 g) を、無水ピリジン中の 2-(2-ヒドロキシエチル) チオフェン (1.723 g) の氷冷溶液に 5 分間かけて少しずつ加えた。 3時間後、反応混合物を激しく撹拌した水(160ml)に注ぎ、沈殿物を生じた。冷却後、固体を収集し、水で洗浄して、標記トシラートの白色結晶(3.555g)を得た、融点33〜34℃、ラムダマックス(EtOH)227nm(E11612)。 | |
| トリエチルアミンを使用すると、ブタノン中。0~30℃。 | 実施例1 2−(2−チエニル)−エチル パラ−トルエンスルホネートの調製 メチルエチルケトン(1000ml)中のp−トルエンスルホニルクロリド(328グラム)および2−(2−チエニル)−エタノール(200グラム)の混合物を、 0℃まで冷却した。続いて、トリエチルアミン(283.1ml)を0〜5℃で1〜2時間かけて滴下し、反応塊を25〜30℃で12〜15時間撹拌した。得られた塊を濾過し、メチルエチルケトン(500ml)で洗浄した。得られた有機層を水(500ml)で洗浄し、続いて飽和重炭酸ナトリウム溶液(500ml)およびブライン溶液(500ml)で洗浄した。得られた有機層を真空下、50℃未満で蒸留して、2−(2−チエニル)−エチル パラ−トルエンスルホネートを油状塊として得た(油の重量:505グラム;HPLCによる純度:97%)。 | |
| トリエチルアミンを使用すると、ブタノン中。0~30℃。 | 実施例1 2−(2−チエニル)−エチル パラ−トルエンスルホネートの調製 メチルエチルケトン(1000ml)中のp−トルエンスルホニルクロリド(328グラム)および2−(2−チエニル)−エタノール(200グラム)の混合物を、続いてトリエチルアミン(283.1ml)を0〜5℃で1〜2時間かけて滴下し、反応塊を25〜30℃で12〜15時間撹拌した。得られた塊を濾過し、メチルエチルケトン(500ml)で洗浄した。得られた有機層を水(500ml)で洗浄し、続いて飽和重炭酸ナトリウム溶液(500ml)およびブライン溶液(500ml)で洗浄した。得られた有機層を真空下、50℃未満で蒸留して、2−(2−チエニル)−エチル パラ−トルエンスルホネートを油状塊として得た(油の重量:505グラム;HPLCによる純度:97%)。 | |
| 炭酸カリウムを使用。トルエン中で;0~20℃。3.5時間。 | 500mlのトルエンを1000mlの反応フラスコに加え、50gのチオフェンエタノールおよび80gのp-トルエンスルホニルクロリドを加え、撹拌を開始し、温度を0℃に制御し、64gの炭酸カリウムを滴下し、添加を約30分間続け、滴下した。 20℃に昇温して3時間反応を終了した。反応溶液に水400mlを加え、2回洗浄した。洗浄したトルエン層をそのまま次の反応に使用した。 | |
| N-エチル-N,N-ジイソプロピルアミンを使用。トルエン中で;0~20℃。3.5時間。 | 1000ml反応フラスコに500mlのトルエンを加え、50gのチオフェンエタノールおよび92gのp-トルエンスルホニルクロリドを0℃で撹拌し、62gのN,N-ジイソプロピルエチルアミンを約30分間滴下した。滴下終了後、20℃に昇温し、3時間反応させた。反応液に水400mlを加えて2回洗浄し、洗浄したトルエン層はそのまま次の反応に用いた。 | |
| トリエチルアミンを使用すると、トルエン中で;0~20℃。3時間。 | 500mlのトルエン、50gのチオフェンエタノールおよび80gのp−トルエンスルホニルクロリドを1000mlの反応フラスコに入れ、温度を3時間かけて20℃に上昇させた。反応液に水400mlを加え、2回洗浄後、トルエンで洗浄し、そのまま次工程の反応に移した。 | |
| 炭酸カリウムを使用。トルエン中で;0~20℃。3.5時間。 | 500mlのトルエン、50gのチオフェンエタノールおよび107gのp-トルエンスルホニルクロリドを1000mlの反応フラスコに入れ、撹拌を開始し、温度を0℃に制御し、64gの炭酸カリウムを滴下し、添加を約3時間続けた。 30分後、20℃に昇温して3時間反応させた後、反応液に水400mlを加え2回洗浄し、洗浄したトルエン層をそのまま次の反応に用いた。 | |
| トリエチルアミンを使用すると、トルエン中で;0~25℃。3.5時間。 | 実施例1 図2に示すチクロピジン塩酸塩の調製方法は、以下のステップを含む:1.p-トルエンスルホニルの保護:1000mlの反応フラスコに、500mlのトルエン、50gのチオフェンエタノールおよび80gのp-トルエンスルホニルクロリドを入れ、0℃の温度で制御するために撹拌し、47gのトリエチルアミンを滴下し、約30分間滴下し、温度を25℃まで3時間上昇させた。400mlの水を加え、2回洗浄し、トルエン層で洗浄して、次の段階の反応に直接移した。2.縮合反応 前工程のトルエンの反応溶液を1000mlの反応フラスコに加え、続いてo−クロロベンジルアミン114gを加え、90℃で3時間加熱した。反応後、混合物を25℃に冷却し、1時間撹拌した。濾液に水200mlを加え、塩酸で系のpHを8.5に調整し、上層にトルエンを加えて層状にし、塩酸を滴下し続けてpH5に調整した後、系を2℃まで冷却し、結晶を1時間混合した。 4時間放置し、濾過し、濾過ケーキを50℃で真空乾燥して、96gの縮合物塩酸塩を得た。閉ループ反応 1000mlの反応フラスコに、96gの縮合物塩酸塩、400mlの1,3−ジオキサンおよび5mlの塩酸を加え、90℃で6時間加熱した。反応後、混合物を7℃に冷却し、3時間撹拌した。濾過ケーキを少量の1,3−ジオキセタンで洗浄した。50℃で真空乾燥した後、95gのチクロピジン塩酸塩を得た。精製1000mlの反応フラスコに、粗チクロピジン塩酸塩95gと無水エタノール500mlを加え、撹拌しながら72℃に加熱した。固体が完全に溶解した約10分後、2gの活性炭を加え、20分後に絶縁漂白した。熱いフィルターで濾液を徐々に冷却し、結晶を4℃で4時間結晶化し、濾過した。フィルターケーキを少量の無水エタノールで洗浄し、50℃で真空乾燥して、91gの塩酸チチオールPrecision生成物を得た。総収率82%、純度99.9% | |
| 水酸化ナトリウムを使用。水中で;トルエン;10~55℃。11時間。 | 三口フラスコにp−トルエンスルホニルクロリド97gとトルエン180mlを入れ、撹拌溶解し、濾過し、15〜20℃に保温し、2−チオフェンエタノール60gとトルエン60mlを加えた。三口フラスコに40%水酸化ナトリウム水溶液120gを加え、撹拌しながら、トルエン180mlに溶解した塩化p-トルエンスルホニル97gの溶液を10~20℃で滴下し、混合物を3時間撹拌した。有機相を減圧してトルエンを除去し、2-(2-チオフェン)エタノール p-トルエンスルホネートを得る。赤褐色の油。分子式は次のとおりです。 | |
| 235.1g | 水酸化ナトリウムを使用。クロロホルム中;0~5℃。12時間。 | 反応フラスコに、上記工程の2-チオフェンエタノール:112g、クロロホルム600g、PTSC249.4gを加え、混合物を0~5℃に冷却した。10質量%水酸化ナトリウム溶液834gを加え、温度を0℃に制御した。 -5℃、12時間保温し、塩酸を加えてpH=12にし、水層を300gのクロロホルムで抽出し、クロロホルム層を合わせる。100gの水で洗浄した後、有機層を蒸留乾固して、2-チオフェンエタノール p-トルエンスルホネートを得た:235.1g、収率95.3%、純度99.5%。 |
ここにあなたのメッセージを書いて、私たちに送ってください

![[ CAS No. 5402-55-1 ] 2-チオフェンエタノール 注目の画像](https://www.ohlsenwin.com/uploads/p1.png)
![[ CAS No. 5402-55-1 ] 2-チオフェンエタノール](https://www.ohlsenwin.com/uploads/p1-300x300.png)
![[ CAS No. 5402-55-1 ] 2-チオフェンエタノール](https://www.ohlsenwin.com/uploads/product-2-300x300.png)
![[ CAS No. 5402-55-1 ] 2-チオフェンエタノール](https://www.ohlsenwin.com/uploads/product-1-300x300.png)





![[ CAS No. 141109-14-0 ] (S)-2-アミノ-2-(2-クロロフェニル)酢酸メチル](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-2-300x300.png)
![[ CAS No. 141109-19-5 ] (S)-メチル 2-(2-クロロフェニル)-2-((2-(チオフェン-2-イル)エチル)アミノ)酢酸塩酸塩](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-31-300x300.png)
![[ CAS No. 40412-06-4 ] 4-メチルベンゼンスルホン酸 2-(チオフェン-2-イル)エチル](https://www.ohlsenwin.com/uploads/ethanol-Tosylate-4-300x300.png)