[ CAS No. 5402-55-1 ] 2-Tiofenoetanol
padrão do produto
| Aparência | Líquido transparente incolor a amarelo claro |
| Teste de Identidade | O tempo de retenção está em conformidade com a referência do GC |
| Pureza | 99% min. (GC)) |
| 3-tiopneno etanol | 0,1% máx. (GC) |
| impureza individual (desconhecido) | 0,2% máx (GC) |
| Teor de água | 0,3% máx. (P/P) |
| Período de novo teste | Um ano |
Detalhes do produto de [ 5402-55-1 ]
| Nº CAS: | 5402-55-1 | Nº MDL: | MFCD00005462 |
| Fórmula : | C6H8OS | Ponto de ebulição : | 223°C a 760 mmHg |
| Fórmula da Estrutura Linear: | - | Chave InChi: | N / D |
| MW: | 128.19g/mol | ID da Pubchem: | 79400 |
| Sinônimos: | |||
Química calculada de [ 5402-55-1 ]
Propriedades físico-químicas
| Num.átomos pesados: | 8 |
| Num.aro.átomos pesados: | 5 |
| Fração Csp3 : | 0,33 |
| Num.ligações rotativas: | 2 |
| Num.Aceitadores de ligação H: | 1,0 |
| Num.Doadores de ligação H: | 1,0 |
| Refratividade Molar: | 35,25 |
| TPSA: | 48,47Ų |
Farmacocinética
| Absorção GI: | Alto |
| BBB permeante: | Sim |
| Substrato P-gp: | No |
| Inibidor CYP1A2: | No |
| Inibidor CYP2C19: | No |
| Inibidor CYP2C9: | No |
| Inibidor CYP2D6: | No |
| Inibidor CYP3A4: | No |
| Log Kp (permeação da pele): | -6,18 cm/s |
Lipofilicidade
| Log Po/w (iLOGP): | 1,75 |
| Log Po/w (XLOGP3): | 1.27 |
| Log Po/w (WLOGP): | 1.28 |
| Log Po/w (MLOGP): | 0,84 |
| Log Po/w (SILICOS-IT): | 2.67 |
| Consenso Log Po/w : | 1,56 |
semelhança com drogas
| Lipinski: | 0,0 |
| Ganso: | Nenhum |
| Veber: | 0,0 |
| Egan: | 0,0 |
| Muegge: | 1,0 |
| Pontuação de biodisponibilidade: | 0,55 |
Solubilidade em água
| Registro S (ESOL): | -1,77 |
| Solubilidade: | 2,2 mg/ml;0,0172 mol/l |
| Aula : | Muito solúvel |
| Log S (Ali): | -1,89 |
| Solubilidade: | 1,66 mg/ml;0,013 mol/l |
| Aula : | Muito solúvel |
| Log S (SILICOS-IT): | -1,86 |
| Solubilidade: | 1,77 mg/ml;0,0138 mol/l |
| Aula : | Solúvel |
Química Medicinal
| DORES: | 0,0 alerta |
| Brenk: | 0,0 alerta |
| Leadlikeness: | 1,0 |
| Acessibilidade sintética: | 1,82 |
Segurança de [ 5402-55-1 ]
| Palavra Sinal: | Aviso | Aula: | N / D |
| Declarações de precaução: | P261-P305+P351+P338 | UN#: | N / D |
| Declarações de perigo: | H302-H315-H319-H335 | Grupo de embalagem: | N / D |
| Pictograma GHS: |  | ||
Declarações de precaução - geral
| Código | Frase |
| P101 | Se for necessário aconselhamento médico, tenha em mãos a embalagem ou o rótulo do produto. |
| P102 | Mantenha fora do alcance de crianças. |
| P103 | Leia o rótulo antes de usar |
Prevenção
| Código | Frase |
| P201 | Obtenha instruções especiais antes de usar. |
| P202 | Não manuseie até que todas as precauções de segurança tenham sido lidas e compreendidas. |
| P210 | Mantenha longe do calor/faíscas/chamas abertas/superfícies quentes.- Proibido fumar. |
| P211 | Não pulverize sobre uma chama aberta ou outra fonte de ignição. |
| P220 | Mantenha/armazene longe de roupas/materiais combustíveis. |
| P221 | Tome todas as precauções para evitar a mistura com combustíveis |
| P222 | Não permita o contato com o ar. |
| P223 | Mantenha-se afastado de qualquer possível contato com a água, devido à reação violenta e possível explosão. |
| P230 | Manter molhado |
| P231 | Manuseie sob gás inerte. |
| P232 | Proteger da humidade. |
| P233 | Mantenha o recipiente bem fechado. |
| P234 | Conservar apenas no recipiente original. |
| P235 | Mantenha a calma |
| P240 | Contêiner de aterramento/ligação e equipamento de recebimento. |
| P241 | Use equipamentos elétricos/de ventilação/iluminação/à prova de explosão. |
| P242 | Use somente ferramentas antifaíscas. |
| P243 | Tome medidas preventivas contra descarga estática. |
| P244 | Mantenha as válvulas de redução livres de graxa e óleo. |
| P250 | Não sujeite a esmerilhamento/choque/fricção. |
| P251 | Recipiente pressurizado: Não furar ou queimar, mesmo após o uso. |
| P260 | Não respire poeira/fumaça/gás/névoa/vapores/spray. |
| P261 | Evite respirar poeira/fumaça/gás/névoa/vapores/spray. |
| P262 | Não coloque nos olhos, na pele ou na roupa. |
| P263 | Evite o contato durante a gravidez/durante a amamentação. |
| P264 | Lave bem as mãos após o manuseio. |
| P265 | Lave a pele cuidadosamente após o manuseio. |
| P270 | Não coma, beba ou fume ao usar este produto. |
| P271 | Use apenas ao ar livre ou em uma área bem ventilada. |
| P272 | Roupas de trabalho contaminadas não devem sair do local de trabalho. |
| P273 | Evitar a libertação para o meio ambiente. |
| P280 | Use luvas de proteção/vestuário de proteção/proteção ocular/proteção facial. |
| P281 | Use equipamento de proteção pessoal conforme necessário. |
| P282 | Use luvas isolantes de frio/proteção facial/proteção ocular. |
| P283 | Use roupas resistentes ao fogo/chamas/retardantes. |
| P284 | Use proteção respiratória. |
| P285 | Em caso de ventilação inadequada, usar proteção respiratória. |
| P231 + P232 | Manuseie sob gás inerte.Proteger da humidade. |
| P235 + P410 | Mantenha a calma.Proteger da luz solar. |
Resposta
| Código | Frase |
| P301 | SE ENGOLIDO: |
| P304 | SE INALADO: |
| P305 | SE NOS OLHOS: |
| P306 | SE NA ROUPA: |
| P307 | SE exposto: |
| P308 | SE exposto ou preocupado: |
| P309 | SE exposto ou se você se sentir mal: |
| P310 | Ligue imediatamente para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P311 | Ligue para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P312 | Ligue para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico se você se sentir mal. |
| P313 | Obter aconselhamento/atenção médica. |
| P314 | Procure aconselhamento/atenção médica se não se sentir bem. |
| P315 | Obtenha aconselhamento/atenção médica imediata. |
| P320 | |
| P302 + P352 | SE NA PELE: lave com bastante água e sabão. |
| P321 | |
| P322 | |
| P330 | Enxágue a boca. |
| P331 | NÃO induza o vômito. |
| P332 | SE ocorrer irritação da PELE: |
| P333 | Se ocorrer irritação ou erupção cutânea: |
| P334 | Mergulhe em água fria/enrole com bandagens molhadas. |
| P335 | Retire as partículas soltas da pele. |
| P336 | Descongele as partes congeladas com água morna.Não esfregue a área afetada. |
| P337 | Se a irritação ocular persistir: |
| P338 | Remova as lentes de contato, se presentes e fáceis de retirar.Continue enxaguando. |
| P340 | Remover a vítima para um local arejado e mantê-la em repouso numa posição que não dificulte a respiração. |
| P341 | Se a respiração estiver difícil, remova a vítima para o ar fresco e mantenha-a em repouso em uma posição confortável para respirar. |
| P342 | Se apresentar sintomas respiratórios: |
| P350 | Lave delicadamente com bastante água e sabão. |
| P351 | Enxaguar cuidadosamente com água durante vários minutos. |
| P352 | Lave com bastante sabão e água. |
| P353 | Enxágue a pele com água/banho. |
| P360 | Lave imediatamente a roupa e a pele contaminadas com bastante água antes de retirar a roupa. |
| P361 | Retirar/retirar imediatamente toda a roupa contaminada. |
| P362 | Tire a roupa contaminada e lave-a antes de reutiliza-lá. |
| P363 | Lave as roupas contaminadas antes de reutilizá-las. |
| P370 | Em caso de fogo: |
| P371 | Em caso de grande incêndio e grandes quantidades: |
| P372 | Risco de explosão em caso de incêndio. |
| P373 | NÃO combata o fogo quando o fogo atingir os explosivos. |
| P374 | Combata o fogo com as precauções normais a uma distância razoável. |
| P376 | Interrompa o vazamento se for seguro fazê-lo.Gases oxidantes (seção 2.4) 1 |
| P377 | Vazamento de incêndio de gás: Não extinga, a menos que o vazamento possa ser interrompido com segurança. |
| P378 | |
| P380 | Evacuar área. |
| P381 | Elimine todas as fontes de ignição se for seguro fazê-lo. |
| P390 | Absorva o derramamento para evitar danos materiais. |
| P391 | Colete o derramamento.Perigoso para o ambiente aquático |
| P301 + P310 | EM CASO DE INGESTÃO: Chame imediatamente um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P301 + P312 | EM CASO DE INGESTÃO: chame um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico SE sentir indisposição. |
| P301 + P330 + P331 | EM CASO DE INGESTÃO: Enxaguar a boca.NÃO induza o vômito. |
| P302 + P334 | SE NA PELE: Mergulhe em água fria/enrole em bandagens molhadas. |
| P302 + P350 | SE NA PELE: Lavar suavemente com água e sabão em abundância. |
| P303 + P361 + P353 | SE ENTRAR EM CONTACTO COM A PELE (ou cabelo): Remover/retirar imediatamente toda a roupa contaminada.Enxágue a PELE com água/banho. |
| P304 + P312 | EM CASO DE INALAÇÃO: Contacte um CENTRO DE INFORMAÇÃO ANTIVENENOS ou um médico/médico se se sentir indisposto. |
| P304 + P340 | EM CASO DE INALAÇÃO: Remover a vítima para um local arejado e mantê-la em repouso numa posição que não dificulte a respiração. |
| P304 + P341 | EM CASO DE INALAÇÃO: Se a respiração estiver difícil, remova a vítima para o ar fresco e mantenha-a em repouso em uma posição confortável para respirar. |
| P305 + P351 + P338 | SE ENTRAR EM CONTATO COM OS OLHOS: Enxaguar cuidadosamente com água durante vários minutos.Remova as lentes de contato, se presentes e fáceis de retirar.Continue enxaguando. |
| P306 + P360 | SE ENTRAR EM CONTACTO COM A ROUPA: Enxaguar imediatamente a ROUPA e a PELE contaminadas com bastante água antes de retirar a roupa. |
| P307 + P311 | SE exposto: chame um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P308 + P313 | SE exposto ou preocupado: Procure aconselhamento/atenção médica. |
| P309 + P311 | SE exposto ou se você se sentir mal: chame um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P332 + P313 | SE ocorrer irritação da PELE: Procure aconselhamento/atenção médica. |
| P333 + P313 | SE ocorrer irritação ou erupção na PELE: Procure orientação/atendimento médico. |
| P335 + P334 | Retire as partículas soltas da pele.Mergulhe em água fria/enrole em bandagens molhadas. |
| P337 + P313 | SE a irritação ocular persistir: consulte um médico. |
| P342 + P311 | SE sentir sintomas respiratórios: chame um CENTRO DE INFORMAÇÃO ANTIVENENOS ou médico/médico. |
| P370 + P376 | Em caso de incêndio: Interrompa o vazamento se for seguro fazê-lo. |
| P370 + P378 | Em caso de fogo: |
| P370 + P380 | Em caso de incêndio: Evacuar a área. |
| P370 + P380 + P375 | Em caso de incêndio: Evacuar a área.Combata o fogo remotamente devido ao risco de explosão. |
| P371 + P380 + P375 | Em caso de grande incêndio e grandes quantidades: Evacue a área.Combata o fogo remotamente devido ao risco de explosão. |
Armazenar
| Código | Frase |
| P401 | |
| P402 | Conservar em local seco. |
| P403 | Armazenar em local bem ventilado. |
| P404 | Armazene em um recipiente fechado. |
| P405 | Loja trancada. |
| P406 | Armazene em recipiente/recipiente resistente à corrosão com revestimento interno resistente. |
| P407 | Mantenha o espaço de ar entre as pilhas/paletes. |
| P410 | Proteger da luz solar. |
| P411 | |
| P412 | Não exponha a temperaturas superiores a 50 oC/ 122 oF. |
| P413 | |
| P420 | Armazene longe de outros materiais. |
| P422 | |
| P402 + P404 | Conservar em local seco.Armazene em um recipiente fechado. |
| P403 + P233 | Armazenar em local bem ventilado.Mantenha o recipiente bem fechado. |
| P403 + P235 | Armazenar em local bem ventilado.Mantenha a calma. |
| P410 + P403 | Proteger da luz solar.Armazenar em local bem ventilado. |
| P410 + P412 | Proteger da luz solar.Não exponha a temperaturas superiores a 50 oC/122oF. |
| P411 + P235 | Mantenha a calma. |
Disposição
| Código | Frase |
| P501 | Descarte o conteúdo/recipiente em... |
| P502 | Consulte o fabricante/fornecedor para obter informações sobre recuperação/reciclagem |
Riscos físicos
| Código | Frase |
| H200 | explosivo instável |
| H201 | Explosivo;perigo de explosão em massa |
| H202 | Explosivo;perigo de projeção grave |
| H203 | Explosivo;risco de incêndio, explosão ou projeção |
| H204 | Perigo de incêndio ou projeção |
| H205 | Pode explodir em massa em incêndio |
| H220 | Gás extremamente inflamável |
| H221 | Gás inflamável |
| H222 | Aerossol extremamente inflamável |
| H223 | aerossol inflamável |
| H224 | Líquido e vapor extremamente inflamáveis |
| H225 | Líquido e vapor altamente inflamáveis |
| H226 | Líquido e vapor inflamáveis |
| H227 | líquido combustível |
| H228 | Sólido inflamável |
| H229 | Recipiente pressurizado: pode estourar se aquecido |
| H230 | Pode reagir explosivamente mesmo na ausência de ar |
| H231 | Pode reagir de forma explosiva mesmo na ausência de ar em pressão e/ou temperatura elevadas |
| H240 | O aquecimento pode causar uma explosão |
| H241 | O aquecimento pode causar incêndio ou explosão |
| H242 | O aquecimento pode causar um incêndio |
| H250 | Pega fogo espontaneamente se exposto ao ar |
| H251 | Auto aquecimento;pode pegar fogo |
| H252 | Auto-aquecimento em grandes quantidades;pode pegar fogo |
| H260 | Em contacto com a água liberta gases inflamáveis que podem inflamar-se espontaneamente |
| H261 | Em contato com a água libera gases inflamáveis |
| H270 | Pode causar ou intensificar incêndios;oxidante |
| H271 | Pode causar incêndio ou explosão;oxidante forte |
| H272 | Pode intensificar o fogo;oxidante |
| H280 | Contém gás sob pressão;pode explodir se aquecido |
| H281 | Contém gás refrigerado;pode causar queimaduras ou lesões criogênicas |
| H290 | Pode ser corrosivo para metais |
Riscos para a saúde
| Código | Frase |
| H300 | Fatal se ingerido |
| H301 | Tóxico se ingerido |
| H302 | Perigoso se ingerido |
| H303 | Pode ser perigoso se engolido |
| H304 | Pode ser mortal por ingestão e penetração nas vias respiratórias |
| H305 | Pode ser prejudicial se ingerido e entrar nas vias respiratórias |
| H310 | Fatal em contato com a pele |
| H311 | Tóxico em contato com a pele |
| H312 | Nocivo em contacto com a pele |
| H313 | Pode ser nocivo em contato com a pele |
| H314 | Causa queimaduras na pele e lesões oculares graves |
| H315 | Causa irritação na pele |
| H316 | Causa leve irritação na pele |
| H317 | Pode causar uma reação alérgica na pele |
| H318 | Causa lesões oculares graves |
| H319 | Causa irritação ocular grave |
| H320 | Causa irritação ocular |
| H330 | Fatal se inalado |
| H331 | Tóxico se inalado |
| H332 | Nocivo se inalado |
| H333 | Pode ser nocivo se inalado |
| H334 | Pode causar sintomas de alergia ou asma ou dificuldades respiratórias se inalado |
| H335 | Pode causar irritação respiratória |
| H336 | Pode causar sonolência ou tonturas |
| H340 | Pode causar defeitos genéticos |
| H341 | Suspeito de causar defeitos genéticos |
| H350 | Pode causar câncer |
| H351 | Suspeito de causar câncer |
| H360 | Pode prejudicar a fertilidade ou o feto |
| H361 | Suspeito de prejudicar a fertilidade ou o nascituro |
| H361d | Suspeito de prejudicar o feto |
| H362 | Pode causar danos a crianças amamentadas |
| H370 | Causa danos aos órgãos |
| H371 | Pode causar danos aos órgãos |
| H372 | Causa danos aos órgãos por exposição repetida ou prolongada |
| H373 | Pode causar danos aos órgãos por exposição repetida ou prolongada |
Perigos ambientais
| Código | Frase |
| H400 | Muito tóxico para a vida aquática |
| H401 | Tóxico para a vida aquática |
| H402 | Nocivo para a vida aquática |
| H410 | Muito toxico para a vida aquática com efeitos de longa duração |
| H411 | Tóxico para a vida aquática com efeitos duradouros |
| H412 | Nocivo para a vida aquática com efeitos duradouros |
| H413 | Pode causar efeitos nocivos duradouros à vida aquática |
| H420 | Prejudica a saúde pública e o meio ambiente ao destruir o ozônio na atmosfera superior |
Aplicação em síntese de [ 5402-55-1 ]
Rota de síntese a montante de [ 5402-55-1 ]
Rota sintética a jusante de [ 5402-55-1 ]
Rota de síntese a montante de [ 5402-55-1 ]
| Colheita | Condições de reação | Operação em experimento |
|---|---|---|
| 72% | Com cepa do fungo zigomiceto S.racemosum MUT 770 Em dimetil sulfóxido por 72 h;reação enzimática | 2.3.Experimentos de biotransformação Cepas fúngicas foram pré-crescidas em placas de Petri contendo meio sólido maltextract (MEA: 20 g L-1 glicose, 20 g L-1 extrato de malte, 20 g L-1 ágar, 2 g L-1 peptona) a partir do qual o inóculo para liquidcultures foi criado.O fungo foi inoculado como suspensão de conídios (1 106 conídios/mL) em 50 mL de amostras contendo 40 mL de meio líquido maltextado.Os frascos foram incubados a 25 C e mantidos sob agitação (110 rpm). Após 2 dias de pré-crescimento, uma solução 500 mM do substrato em DMSO foi adicionada, para uma concentração inicial de substrato (c0) de 1–5 mM.Para cada substrato, três réplicas biológicas foram executadas. O experimento foi executado por 3 dias após a adição dos substratos, durante os quais amostras de 1 mL foram coletadas, em intervalos especificados (geralmente 24, 48 e 72 h).Cada amostra foi extraída com EtOAc (500 L), a fase orgânica foi seca sobre Na2SO4 anidro e analisada por meio de GC/MS.Em alguns casos (ver Seção 2.4) foi realizado o isolamento do produto reduzido. Para cada conjunto de biotransformações, um ask foi usado para medir a biomassa inicial e o pH antes da adição do substrato. Esses parâmetros também foram avaliados no final do experimento para todas as perguntas.O meio líquido foi separado da biomassa por filtração e foi usado para medição de pH enquanto os micélios foram secos a 60 C por 24 h para medir o peso seco da biomassa.2-(tiofen-2-il)etanol: de ácido 2-(tiofen-2-il)acético (3,7 mg, 72 por cento) e de metil 2-(tiofen-2-il) acetato (24,6 mg, 96 por cento).1H NMR (400 MHz, CDCl3, TMS): = 7,20 (m, 1H, hidrogênio heteroaromático), 6,99 (m, 1H, hidrogênio heteroaromático), 6,90 (m,1H, hidrogênio heteroaromático), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02(t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCl3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
| 66,5% | Estágio #1: Com tetra-hidreto de alumínio e lítio em tetra-hidrofurano a 0 - 20 ℃; Fase #2: Com água;cloreto de sódio em tetrahidrofurano a 0℃; | Passo 9 2-(tiofen-2-il)etanol: A cerca de 0°C, uma solução de ácido tiofen-2-il-acético (1,0 g; 7,03 mmol) em tetra-hidrofurano (10 mL) foi adicionada gota a gota a uma suspensão de hidreto de alumínio e lítio (0,534 g; 14,05 mmol) em solução seca tetra-hidrofurano (10 mL). A mistura foi agitada à temperatura ambiente por cerca de 4 horas e depois resfriada a cerca de 0°C. Depois de adicionar uma solução saturada fria de cloreto de sódio (1 mL), a mistura foi filtrada e os sais inorgânicos foram lavados com tetra-hidrofurano e acetato de etila. O filtrado e as lavagens foram combinados e concentrados in vacuo para dar o composto do título como um óleo marrom (0,600 g; 66,5 por cento). 1H RMN (400 MHz, CDCl3) δ 1,60 (br, trocável com D2O, 1H), 3,08 (t, J=6,2 Hz, 2H), 3,85 (t, J=6,2 Hz, 2H), 6,87-6,88 (m, 1H), 6,95-6,97 (m, 1H), 7,16-7,25 (m, 1H).IR (filme) υ 3345, 3105, 2211, 2126, 2090, 1792, 1433, 1138, 972, 737, 699 cm-1EM: 129 (M+1). |
| Colheita | Condições de reação | Operação em experimento |
|---|---|---|
| 96% | Com cepa do fungo zigomiceto S.racemosum MUT 770 Em dimetil sulfóxido por 72 h;reação enzimática | 2.3.Experimentos de biotransformação Cepas fúngicas foram pré-crescidas em placas de Petri contendo meio sólido maltextract (MEA: 20 g L-1 glicose, 20 g L-1 extrato de malte, 20 g L-1 ágar, 2 g L-1 peptona) a partir do qual o inóculo para liquidcultures foi criado.O fungo foi inoculado como suspensão de conídios (1 106 conídios/mL) em 50 mL de amostras contendo 40 mL de meio líquido maltextado.Os frascos foram incubados a 25 C e mantidos sob agitação (110 rpm). Após 2 dias de pré-crescimento, uma solução 500 mM do substrato em DMSO foi adicionada, para uma concentração inicial de substrato (c0) de 1–5 mM.Para cada substrato, três réplicas biológicas foram executadas. O experimento foi executado por 3 dias após a adição dos substratos, durante os quais amostras de 1 mL foram coletadas, em intervalos especificados (geralmente 24, 48 e 72 h).Cada amostra foi extraída com EtOAc (500 L), a fase orgânica foi seca sobre Na2SO4 anidro e analisada por meio de GC/MS.Em alguns casos (ver Seção 2.4) foi realizado o isolamento do produto reduzido. Para cada conjunto de biotransformações, um ask foi usado para medir a biomassa inicial e o pH antes da adição do substrato. Esses parâmetros também foram avaliados no final do experimento para todas as perguntas.O meio líquido foi separado da biomassa por filtração e foi usado para medição de pH enquanto os micélios foram secos a 60 C por 24 h para medir o peso seco da biomassa.2-(tiofen-2-il)etanol: de ácido 2-(tiofen-2-il)acético (3,7 mg, 72 por cento) e de metil 2-(tiofen-2-il) acetato (24,6 mg, 96 por cento).1H NMR (400 MHz, CDCl3, TMS): = 7,20 (m, 1H, hidrogênio heteroaromático), 6,99 (m, 1H, hidrogênio heteroaromático), 6,90 (m,1H, hidrogênio heteroaromático), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02(t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCl3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
Rota sintética a jusante de [ 5402-55-1 ]
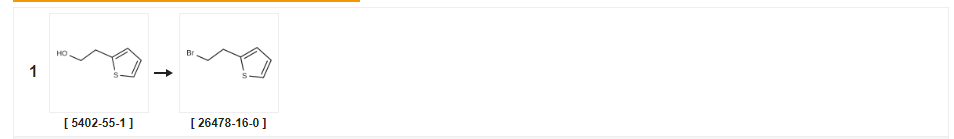
| Colheita | Condições de reação | Operação em experimento |
|---|---|---|
| 94% | Com tetrabrometo de carbono;trifenilfosfina Em tetrahidrofurano a 0℃;técnica de Schlenk;Atmosfera inerte; | |
| 69% | Com bromo;trifenilfosfina em diclorometano a 20℃; | |
| 64% | P.31 Síntese de 2-(2-bromoetil)tiofeno Exemplo de Produção 31 Síntese de 2-(2-bromoetil)tiofeno 2-Tieniletanol (0,44 mL) foi tratado como no Exemplo de Produção 1 acima para dar o composto do título (0,490 g) como um óleo incolor (rendimento: 64,0%).1H-NMR (400 MHz, CDCl3): δ(ppm) 3,38(2H, t, J=7,6Hz), 3,58(2H, t, J=7,6Hz), 6,89(1H, d, J=1,2Hz), 6,96(1H, d, J=4,2Hz), 7,19(1H, dd, J=1,2, 4,2Hz). |
| 28% | Com tribrometo de fósforo Em diclorometano a 0 - 20℃;por 1h; | |
| 19% | Com tribrometo de fósforo Em tetraclorometano a 65℃;por 0,333333h; | a Tribrometo de fósforo (2,0 mL, 21,1 mmol) foi adicionado a uma solução agitada de 2-(tiofen-2-il)etanol (2,25 g, 17,6 mmol) em tetracloreto de carbono (162 mL), em seguida, a mistura foi aquecida a 65°C por 20 minutos.A mistura foi deixada arrefecer até à temperatura ambiente e depois adicionou-se gelo.A camada orgânica foi separada, em seguida, a camada aquosa foi extraída com diclorometano (2 x 30 mL).As camadas orgânicas combinadas foram lavadas com salmoura, depois secas (NaSO4), filtradas e reduzidas in vacuo.O resíduo foi purificado por cromatografia flash sobre sílica, eluindo com misturas de acetato de etil:hexano 0:100 a 0,5:95,5 para dar 2-(2-bromoetil)tiofeno como um óleo marrom (650 mg, 19%). |
| Com piridina;clorofórmio;tribrometo de fósforo | ||
| Com tribrometo de fósforo em éter dietílico a 0℃;por 4h; | 2D Exemplo 2D;9-(4,5-Dimetil-tiazol-2-il)-4-[4-(2-tiofen-2-il-etil)-piperazin-1-il]-5,6,7, 8-TETRAHIDRO- 1, 3, 4B-TRIAZA-FLUORENE A uma solução de 2-(2-tienil) etanol (1,63 g) em éter seco (15 mL) a 0°C foi adicionado PBr3 (1,31 mL) gota a gota.Após 4 horas, a mistura de reação foi diluída com diclorometano, lavada com água, seca (MGS04) e o solvente removido in vacuo para produzir um óleo marrom que foi purificado usando cromatografia flash para produzir 2-(2-bromo-etil)-tiofeno.Uma mistura de 9-(4,5-DIMETIL-TIAZOL-2-IL)-4-PIPERAZIN-1-IL-5,6,7,8-TETRAHIDRO-1,3,4b-triaza-fluoreno (85 mg), 2-(2-bromo-etil)-tiofeno (44 mg) e carbonato de potássio (38 mg) foi aquecido a refluxo em acetonitrilo (5 mL) durante 4 horas.A mistura de reação foi resfriada, extraída em diclorometano, seca (MGS04) e o solvente removido in vacuo para produzir o produto bruto que foi purificado usando cromatografia flash para produzir o composto do título (30 mg). |
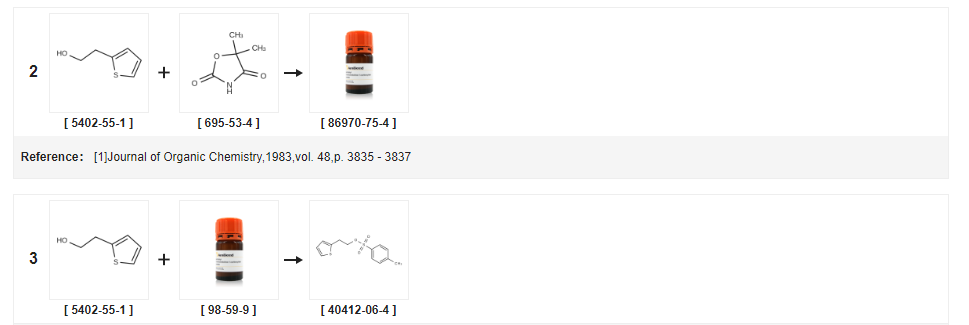
| Colheita | Condições de reação | Operação em experimento |
|---|---|---|
| 98% | Com trietilamina;a 35℃; Resfriamento com gelo; | (0,87 mol) de 2-tiofenoetanol e 184 g (0,97 mol) de cloreto de p-toluenossulfonil foram adicionados sequencialmente a um balão de três tubuladuras de 1 L, 98 g (0,97 mol) de trietilamina foram adicionados gota a gota sob banho de água gelada, E mantenha a temperatura do líquido de reação não superior a 20 DEG C, deixando cair, aquecendo a 35 DEG C para continuar mexendo, respectivamente 24h, 27h de amostragem, TLC, até que a reação esteja completa, pare a reação, filtração, filtro de bolo com apropriado quantidade de diclorometano E a camada de cloreto de metileno foi seca com sulfato de sódio anidro durante 2 horas.O dessecante foi separado por filtração e o dessecante foi lavado com uma pequena quantidade de cloreto de metileno.O filtrado foi descomprimido in vacuo e o filtrado foi evaporado sob pressão reduzida.Concentrado a peso constante para ser óleo marrom, pesando 203g, rendimento 98%, |
| 96,37% | Com trietilamina;Em tolueno;a 5 - 30 ℃;por 20.8333h;Distribuição/seletividade do produto; | EXEMPLO 3 Preparação de Para-Toluenossulfonato de 2-Tieniletilo (Fórmula VII) Usando Tolueno 400 litros de tolueno e 163,2 kg de cloreto de para-tolueno sulfonil foram carregados em um reator limpo e seco seguido de resfriamento a cerca de 5°C. 100 kg de tiofeno- 2-etanol foi adicionado a cerca de 5°C durante cerca de 20 minutos seguido pela adição de 130 kg de trietilamina durante cerca de 8 horas e 50 minutos.A temperatura da mistura de reação foi aumentada para cerca de 30 C, seguida de agitação por cerca de 12 horas.A massa de reação foi filtrada através de um filtro Nutsche e lavada com 2 x 100 litros de tolueno.O filtrado da reação foi transferido para outro reator seguido de lavagem com 5 x 200 litros de água.As camadas orgânica e aquosa foram separadas e a camada orgânica foi destilada completamente a cerca de 70°C sob vácuo para gerar 212 kg (rendimento: 96,37%) do composto do título.Pureza por GC: 95,59%. |
| 96,5% | Com trietilamina;Em diclorometano;a -5 - 20 ℃;por 2h; | 32,7 g (0,17 mol) de cloreto de p-toluenossulfonil, 40 ml de diclorometano no balão de reação, resfriado a -5 C, 20 g (0,16 mol)2-tiofenoetanol. 28,4 g (0,28 mol) de trietilamina foram lentamente adicionados gota a gota e a temperatura da solução de reação foi mantida em cerca de 0 C. Mais Bi, incubada por 2h após a reação ser aquecida à temperatura ambiente.Etanol 2-tiofeno para ser consumido até as matérias-primas, filtração por sucção. O sólido foi lavado com uma pequena quantidade de cloreto de metileno e o filtrado foi lavado com 50 mL de bicarbonato de sódio saturado e seco sobre sulfato de sódio anidro.Filtração, concentração do filtrado, sólido marrom claro precipitado, filtrado, lavado com uma pequena quantidade de éter de petróleo para branco, ou seja, éster etílico de P-toluenossulfonato-2-tiofeno 42,5 g, rendimento de 96,5% (pureza HPLC 99%) |
| 95,5% | Com trietilamina;Em diclorometano;a 7,5 - 22,5 ℃;por 5h;Distribuição/seletividade do produto; | EXEMPLO 10 Preparação de Tosilato de 2-(2-Tiofeno)Etanol (Fórmula VII) Usando Diclorometano 4 litros de diclorometano foram adicionados a um reator a uma temperatura de cerca de 30 C., resfriados a uma temperatura de cerca de 7,5 C. ao qual foi então adicionou 1,784 kg de cloreto de p-tolueno sulfonil seguido por 1 kg de tiofeno-2-etanol.1,302 kg de trietilamina foram adicionados à massa de reação acima a uma temperatura de cerca de 7,5 C, seguido de aumento lento da temperatura da massa de reação para 22,5 C durante cerca de 5 horas.A massa de reação obtida foi filtrada através de um filtro Nutsche de pressão, lavada com cloreto de metileno (2 x 1 litro) e o licor mãe foi coletado e transferido para outro reator.A camada orgânica foi lavada com água (5 x 2 litros).A camada orgânica assim obtida foi submetida a destilação a uma temperatura inferior a 70 C, utilizando circulação de água quente.O resíduo obtido foi então resfriado a cerca de 30°C para gerar 2,1 kg (rendimento: 95,5%) do composto do título. |
| 93,6% | Com trietilamina;Em tolueno;a 45 ℃;por 4h; | Exemplo 1 0.2.Conversão de bromidrato de (S)-1,2,3,4-tetrahidro-5-hvdroxi-N-propil-naftalen-2-amónio (VIII) em sal cloridrato de rotigotina;10.2.1.Preparação de sulfonato de 2-(2-tienil)etil-4-tolueno;Cloreto de 4-toluenossulfonilo (162 g), tolueno (363,3 g) e 2-(2-tienil)etanol (104 g) são combinados.Trietilamina (93 g) é adicionada mantendo a temperatura inferior a 45°C. Após 4 horas, a mistura é lavada com ácido fosfórico aquoso, hidróxido de sódio aquoso e depois água.A fase orgânica é destilada sob vácuo.Isopropanol (314 g) e heptanos (365,9 g) são adicionados.O lote é cristalizado por resfriamento e isolado a -15 C. Os cristais são filtrados e lavados com heptanos (175 mL).Os cristais são então secos sob vácuo à temperatura ambiente até que um ponto de fusão de > 30 C seja obtido. Rendimento ( 214 g): 93,6 % Análises de HPLC confirmaram pureza > 99% e 100 % de ensaio em comparação com um padrão de referência. |
| 93,6% | Com trietilamina;Em tolueno;a 45 ℃;por 4h; | Cloreto de 4-toluenossulfonilo (162 g), tolueno (363,3 g) e 2-(2-tienil)etanol (104 g) são combinados.Trietilamina (93 g) é adicionada mantendo a temperatura inferior a 45°C. Após 4 horas, a mistura é lavada com ácido fosfórico aquoso, hidróxido de sódio aquoso e depois água.A fase orgânica é destilada sob vácuo.Isopropanol (314 g) e heptanos (365,9 g) são adicionados.O lote é cristalizado por resfriamento e isolado a -15 C. Os cristais são filtrados e lavados com heptanos (175 mL).Os cristais são então secos sob vácuo à temperatura ambiente até se obter um ponto de fusão de 30°C.[0255] Rendimento (214 g): 93,6% |
| 90% | Com gel de sílica;Em diclorometano;por 2h; Refluxo; | Os 12,8 g (0,1 mol) 2- (2-tienil) etanol, 1000 mL de diclorometano, 21,0 g (0,12 mol) de cloreto de ácido p-toluenossulfônico e 10,0 g de sílica gel no balão de reação, a reação foi submetida a refluxo por 2 h, resfriado, filtrado para remover sílica gel. A mistura de reação foi lavada sucessivamente com água destilada, solução saturada de carbonato de sódio, salmoura, então o solvente cloreto de metileno foi removido por destilação sob pressão reduzida, para dar 26,0 g de ácido p-toluenossulfônico Preparação de 2 - (2-tienil) etil éster, 90% de rendimento. |
| Em piridina;água; | (a) Tosilato de 2-(2-hidroxietil)tiofeno Cloreto de tolueno-4-sulfonil (4,125 g) foi adicionado em porções ao longo de 5 minutos a uma solução gelada de 2-(2-hidroxietil)tiofeno (1,723 g) em piridina anidra (20 ml) e a solução amarela pálida resultante foi agitada a 0°C. Após 3 h a mistura de reação foi vertida em água vigorosamente agitada (160 ml) produzindo um precipitado.Após resfriamento, o sólido foi coletado e lavado com água para dar cristais brancos do tosilato do título (3,555 g), pf 33-34 C, lambdamax (EtOH) 227 nm (E11 612). | |
| Com trietilamina;Em butanona;a 0 - 30 ℃; | Exemplo 1 Preparação de para-toluenossulfonato de 2-(2-tienil)-etil Uma mistura de cloreto de p-toluenossulfonil (328 gm) e 2-(2-tienil)-etanol (200 gm) em metiletilcetona (1000 ml) foi resfriado a 0C.Isto foi seguido pela adição gota a gota de trietilamina (283,1 mL) a 0-5C durante um período de 1 a 2 horas, e a massa de reação foi agitada durante 12 a 15 horas a 25-3O0C.A massa resultante foi filtrada e lavada com metiletilcetona (500 ml).A camada orgânica resultante foi lavada com água (500 ml) seguida de lavagens com solução saturada de bicarbonato de sódio (500 ml) e solução salina (500 ml).A camada orgânica resultante foi destilada sob vácuo abaixo de 50C para dar 2-(2-tienil)-etil para-toluenossulfonato como uma massa oleosa (Peso do óleo: 505 gm; Pureza por HPLC: 97%). | |
| Com trietilamina;Em butanona;a 0 - 30 ℃; | Exemplo 1 Preparação de para-toluenossulfonato de 2-(2-tienil)-etil Uma mistura de cloreto de p-toluenossulfonil (328 gm) e 2-(2-tienil)-etanol (200 gm) em metiletilcetona (1000 ml) foi resfriado a 0 C. Isto foi seguido pela adição gota a gota de trietilamina (283,1 ml) a 0-5 C. durante um período de 1 a 2 horas, e a massa de reação foi agitada por 12 a 15 horas a 25-30 C A massa resultante foi filtrada e lavada com metiletilcetona (500 ml).A camada orgânica resultante foi lavada com água (500 ml) seguida de lavagens com solução saturada de bicarbonato de sódio (500 ml) e solução salina (500 ml).A camada orgânica resultante foi destilada sob vácuo abaixo de 50 C para dar 2-(2-tienil)-etil para-toluenossulfonato como uma massa oleosa (Peso do óleo: 505 gm; Pureza por HPLC: 97%). | |
| Com carbonato de potássio;Em tolueno;a 0 - 20 ℃;por 3,5h; | 500 ml de tolueno foram adicionados a um balão de reação de 1000 ml, 50 g de tiofeno etanol e 80 g de cloreto de p-toluenossulfonil. Ligue a agitação. A temperatura controlada foi adicionada gota a gota a 0 C64 g de carbonato de potássio. A adição continuou por cerca de 30 min. terminou o aquecimento a 20 C reação por 3 horas, à solução de reação foram adicionados 400 ml de água, lavados duas vezes, a camada de tolueno lavada foi usada diretamente para a próxima reação. | |
| Com N-etil-N,N-diisopropilamina;Em tolueno;a 0 - 20 ℃;por 3,5h; | 500 ml de tolueno foram adicionados a um frasco de reação de 1000 ml, 50 g de tiofeno etanol e 92 g de cloreto de p-toluenossulfonil, agitados a 0 C, 62 g de N,N-diisopropiletilamina foram adicionados por cerca de 30 min.Quando a gota foi completada, a mistura foi aquecida a 20°C e reagiu por 3 horas.À solução reacional foram adicionados 400 ml de água, lavados duas vezes, a camada de tolueno lavada foi usada diretamente para a próxima reação. | |
| Com trietilamina;Em tolueno;a 0 - 20 ℃;por 3h; | 500 ml de tolueno, 50 g de tiofeno etanol e 80 g de cloreto de p-toluenossulfonil foram colocados em um balão de reação de 1000 ml e a temperatura foi elevada para 20 C por 3 horas.400 ml de água foram adicionados à solução de reação, lavados duas vezes, lavados com tolueno, camada diretamente para a próxima etapa de reação. | |
| Com carbonato de potássio;Em tolueno;a 0 - 20 ℃;por 3,5h; | 500 ml de tolueno, 50 g de tiofeno etanol e 107 g de cloreto de p-toluenossulfonil foram colocados em um balão de reação de 1000 ml, a agitação foi ligada, a temperatura foi controlada a 0 C, adição gota a gota de 64 g de carbonato de potássio, a adição durou cerca de 30 min, após o que foi aquecido a 20 C e feito reagir durante 3 horas, à solução reaccional adicionou-se 400 ml de água, lavou-se duas vezes e a camada de tolueno lavada foi utilizada directamente para a reacção seguinte. | |
| Com trietilamina;Em tolueno;a 0 - 25 ℃;por 3,5h; | Exemplo 1O método de preparação do cloridrato de ticlopidina conforme mostrado na Fig. 2 compreende as seguintes etapas:1.Proteção de p-toluenossulfonil: Em um frasco de reação de 1000 ml, 500 ml de tolueno, 50 g de tiofeno etanol e 80 g de cloreto de p-toluenossulfonil foram carregados e agitados para controlarA uma temperatura de 0 C, 47 g de trietilamina foram adicionados gota a gota, caindo por cerca de 30 min, e a temperatura foi aumentada para 25 C por 3 horas. Adicionar 400ml de água, lavado duas vezes, lavado com camada de tolueno diretamente para a próxima etapa de reação.2.Reação de condensação A solução reacional de tolueno na etapa anterior foi adicionada a um balão de reação de 1000 ml, seguido pela adição de 114 g de o-clorobenzilamina e aquecimento a 90 C por 3 horas.Após a reação, a mistura foi resfriada a 25 C e agitada por 1 hora.O filtrado foi adicionado com 200 ml de água e ácido clorídricoAjustar o pH do sistema para 8,5, estratificar a camada superior de tolueno e continuar caindo ácido clorídrico para ajustar o pH para 5, depois resfriar o sistema para 2 COs cristais foram misturados por 4 horas e filtrada, e a torta de filtro foi seca in vacuo a 50 C para dar 96 g do cloridrato condensado.3 ?Reação de circuito fechadoAo balão de reação de 1000 ml foram adicionados 96 g do cloridrato condensado, 400 ml de 1,3-dioxano e 5 ml de ácido clorídrico, a 90 C por 6 horas.Após a reação, a mistura foi resfriada a 7 C e agitada por 3 horas.A torta do filtro foi lavada com uma pequena quantidade de 1,3-dioxetano Após secagem a vácuo a 50°C, obteve-se 95 g de cloridrato de ticlopidina4 ?RefinadoEm um balão de reação de 1000 ml, 95 g de cloridrato de ticlopidina bruto e 500 ml de etanol absoluto foram adicionados e aquecidos a 72 C com agitação, cerca de 10 minutos após o sólido ser completamente dissolvido pela adição de 2g de carvão ativado, branqueamento de isolamento 20 minutos após o filtro quente, o filtrado resfriando gradualmente. Os cristais foram cristalizados a 4 C por 4 horas e filtrados.A torta de filtro foi lavada com uma pequena quantidade de etanol absoluto e seca in vacuo a 50 C para dar 91 g de produtos de cloridrato de titiolPrecision.Rendimento total 82%, pureza 99,9% | |
| Com hidróxido de sódio;Na água;tolueno;a 10 - 55 ℃;por 11h; | Em um balão de três tubuladuras, 97 g de cloreto de p-toluenossulfonil e 180 ml de tolueno foram colocados. um balão de três tubuladuras. 120 g de hidróxido de sódio aquoso a 40%, agitação, Uma solução de 97 g de cloreto de p-toluenossulfonil dissolvido em 180 ml de tolueno foi adicionada gota a gota a 10-20 C e a mistura foi agitada por 3 h, então aquecido a 45-55 C por 8 h e deixado em repouso para estratificação. A fase orgânica é despressurizada para remover o tolueno para dar 2-(2-tiofeno)etanol p-toluenossulfonato. Óleo marrom avermelhado;a fórmula molecular é a seguinte: | |
| 235,1 g | Com hidróxido de sódio;Em clorofórmio;a 0 - 5 ℃;por 12h; | Para o balão de reação, a etapa acima 2-tiofeno etanol: 112 g, clorofórmio 600 g, PTSC 249,4 g, e a mistura foi resfriada a 0-5 C. Adicione 834 g de 10% em massa de solução de hidróxido de sódio, controle a temperatura 0 -5 C, manter quente por 12h, adicionar ácido clorídrico a pH=12, camada, a camada de água é extraída com 300g de clorofórmio e a camada de clorofórmio é combinada.Após lavagem com 100 g de água, a camada orgânica foi destilada até à secura para dar 2-tiofenoetanol p-toluenossulfonato: 235,1 g rendimento 95,3%, pureza 99,5%. |
Escreva sua mensagem aqui e envie para nós

![[ CAS No. 5402-55-1 ] 2-Tiofenoetanol Imagem em Destaque](https://www.ohlsenwin.com/uploads/p1.png)
![[ CAS No. 5402-55-1 ] 2-Tiofenoetanol](https://www.ohlsenwin.com/uploads/p1-300x300.png)
![[ CAS No. 5402-55-1 ] 2-Tiofenoetanol](https://www.ohlsenwin.com/uploads/product-2-300x300.png)
![[ CAS No. 5402-55-1 ] 2-Tiofenoetanol](https://www.ohlsenwin.com/uploads/product-1-300x300.png)





![[ CAS No. 141109-14-0 ] (S)-Metil 2-amino-2-(2-clorofenil)acetato](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-2-300x300.png)
![[ CAS No. 141109-19-5 ] Cloridrato de (S)-metil 2-(2-clorofenil)-2-((2-(tiofen-2-il)etil)amino)acetato](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-31-300x300.png)
![[ CAS No. 40412-06-4 ] 2-(Tiofen-2-il)etil 4-metilbenzenossulfonato](https://www.ohlsenwin.com/uploads/ethanol-Tosylate-4-300x300.png)