[CAS nr. 5402-55-1] 2-tiofenetanol
produktstandard
| Utseende | Klorfri till ljusgul transparent vätska |
| Identitetstest | Retentionstid till överensstämmer med referens från GC |
| Renhet | 99 % min. (GC)) |
| 3-tiopnenetanol | 0,1 % max (GC) |
| Individuell orenhet (okänd) | 0,2 % max (GC) |
| Vatten innehåll | 0,3 % max (W/W) |
| Omtestperiod | Ett år |
Produktinformation för [ 5402-55-1 ]
| CAS-nr: | 5402-55-1 | MDL-nr: | MFCD00005462 |
| Formel: | C6H8OS | Kokpunkt : | 223°C vid 760 mmHg |
| Linjär strukturformel: | - | InChI-nyckel: | N/A |
| MW: | 128,19g/mol | Pubchem ID: | 79400 |
| Synonymer: | |||
Beräknad kemi för [ 5402-55-1 ]
Fysikalisk-kemiska egenskaper
| Num.tunga atomer: | 8 |
| Num.arom.tunga atomer: | 5 |
| Fraktion Csp3 : | 0,33 |
| Num.roterbara bindningar: | 2 |
| Num.H-bindningsacceptorer: | 1.0 |
| Num.H-bonddonatorer: | 1.0 |
| Molär refraktivitet: | 35,25 |
| TPSA: | 48,47Ų |
Farmakokinetik
| GI absorption: | Hög |
| BBB permeant: | Ja |
| P-gp substrat: | No |
| CYP1A2-hämmare: | No |
| CYP2C19-hämmare: | No |
| CYP2C9-hämmare: | No |
| CYP2D6-hämmare: | No |
| CYP3A4-hämmare: | No |
| Log Kp (hudgenomträngning): | -6,18 cm/s |
Lipofilicitet
| Logga Po/w (iLOGP): | 1,75 |
| Logga Po/w (XLOGP3): | 1,27 |
| Logga Po/w (WLOGP): | 1,28 |
| Logga Po/w (MLOGP): | 0,84 |
| Logga Po/w (SILICOS-IT): | 2,67 |
| Konsensuslogg Po/w : | 1,56 |
Droglikhet
| Lipinski: | 0,0 |
| Ghose: | Ingen |
| Veber: | 0,0 |
| Egan: | 0,0 |
| Muegge: | 1.0 |
| Biotillgänglighetspoäng: | 0,55 |
Vattenlöslighet
| Logg S (ESOL): | -1,77 |
| Löslighet: | 2,2 mg/ml;0,0172 mol/l |
| Klass : | Mycket löslig |
| Logg S (Ali): | -1,89 |
| Löslighet: | 1,66 mg/ml;0,013 mol/l |
| Klass : | Mycket löslig |
| Logg S (SILICOS-IT): | -1,86 |
| Löslighet: | 1,77 mg/ml;0,0138 mol/l |
| Klass : | Löslig |
Medicinsk kemi
| SMÄRTOR: | 0,0 varning |
| Brenk: | 0,0 varning |
| Blylikhet: | 1.0 |
| Syntetisk tillgänglighet: | 1,82 |
Säkerhet för [ 5402-55-1 ]
| Signalord: | Varning | Klass: | N/A |
| Skyddsangivelser: | P261-P305+P351+P338 | FN#: | N/A |
| Faroangivelser: | H302-H315-H319-H335 | Förpackningsgrupp: | N/A |
| GHS-piktogram: |  | ||
Försiktighetsangivelser-Allmänt
| Koda | Fras |
| P101 | Om medicinsk rådgivning behövs, ha produktbehållare eller etikett till hands. |
| P102 | Förvara utom räckhåll för barn. |
| P103 | Läs etiketten före användning |
Förebyggande
| Koda | Fras |
| P201 | Skaffa speciella instruktioner före användning. |
| P202 | Hantera inte förrän alla säkerhetsföreskrifter har lästs och förståtts. |
| P210 | Håll borta från värme/gnistor/öppen låga/heta ytor.- Ingen rökning. |
| P211 | Spraya inte på öppen låga eller annan antändningskälla. |
| P220 | Håll/förvara borta från kläder/brännbara material. |
| P221 | Vidta alla försiktighetsåtgärder för att undvika att blanda med brännbara ämnen |
| P222 | Tillåt inte kontakt med luft. |
| P223 | Håll dig borta från eventuell kontakt med vatten, på grund av våldsamma reaktioner och eventuell blixtbrand. |
| P230 | Håll blöt |
| P231 | Hantera under inert gas. |
| P232 | Skydda mot fukt. |
| P233 | Förvara behållaren väl tillsluten. |
| P234 | Förvara endast i originalförpackningen. |
| P235 | Håll dig svalt |
| P240 | Jorda/bonda behållare och mottagande utrustning. |
| P241 | Använd explosionssäker el/ventilation/belysning/utrustning. |
| P242 | Använd endast gnistfri verktyg. |
| P243 | Vidta försiktighetsåtgärder mot statisk urladdning. |
| P244 | Håll reduktionsventiler fria från fett och olja. |
| P250 | Utsätt inte för slipning/chock/friktion. |
| P251 | Tryckbehållare: Får inte sticka hål eller brännas, inte ens efter användning. |
| P260 | Andas inte in damm/rök/gas/dimma/ångor/spray. |
| P261 | Undvik att andas in damm/rök/gas/dimma/ångor/spray. |
| P262 | Får inte komma i ögonen, huden eller kläderna. |
| P263 | Undvik kontakt under graviditet/under amning. |
| P264 | Tvätta händerna noggrant efter hantering. |
| P265 | Tvätta huden noggrant efter hantering. |
| P270 | Ät, drick eller rök inte när du använder denna produkt. |
| P271 | Använd endast utomhus eller i ett välventilerat utrymme. |
| P272 | Förorenade arbetskläder ska inte tillåtas lämna arbetsplatsen. |
| P273 | Undvik utsläpp till miljön. |
| P280 | Använd skyddshandskar/skyddskläder/ögonskydd/ansiktsskydd. |
| P281 | Använd personlig skyddsutrustning vid behov. |
| P282 | Använd kylisolerande handskar/ansiktsskydd/ögonskydd. |
| P283 | Bär brand-/flamsäkra/hämmande kläder. |
| P284 | Använd andningsskydd. |
| P285 | Använd andningsskydd vid otillräcklig ventilation. |
| P231 + P232 | Hantera under inert gas.Skydda mot fukt. |
| P235 + P410 | Håll dig svalt.Skydda från solljus. |
Svar
| Koda | Fras |
| P301 | OM SVALD: |
| P304 | VID INANDNING: |
| P305 | OM I ÖGONEN: |
| P306 | OM PÅ KLÄDER: |
| P307 | OM exponerad: |
| P308 | OM exponerad eller orolig: |
| P309 | OM exponerad eller om du mår dåligt: |
| P310 | Ring omedelbart en GIFTINFORMATIONSCENTRAL eller läkare. |
| P311 | Kontakta GIFTINFORMATIONSCENTRAL eller läkare. |
| P312 | Kontakta GIFTINFORMATIONSCENTRAL eller läkare om du mår dåligt. |
| P313 | Få medicinsk rådgivning/uppmärksamhet. |
| P314 | Sök läkarhjälp om du mår dåligt. |
| P315 | Sök omedelbart medicinsk rådgivning/uppmärksamhet. |
| P320 | |
| P302 + P352 | VID HUDKONTAKT: tvätta med mycket tvål och vatten. |
| P321 | |
| P322 | |
| P330 | Skölj munnen. |
| P331 | Framkalla INTE kräkning. |
| P332 | OM HUDirritation uppstår: |
| P333 | Om hudirritation eller hudutslag uppstår: |
| P334 | Sänk ned i kallt vatten/linda n våta bandage. |
| P335 | Borsta bort lösa partiklar från huden. |
| P336 | Tina frostade delar med ljummet vatten.Gnugga inte det drabbade området. |
| P337 | Om ögonirritation kvarstår: |
| P338 | Ta bort kontaktlinser, om sådana finns och lätt att göra.Fortsätt skölja. |
| P340 | Flytta den skadade till frisk luft och låt vila i en ställning som underlättar andningen. |
| P341 | Om det är svårt att andas, flytta den skadade till frisk luft och låt vila i en ställning som underlättar andningen. |
| P342 | Om du upplever luftvägssymtom: |
| P350 | Tvätta försiktigt med mycket tvål och vatten. |
| P351 | Skölj försiktigt med vatten i flera minuter. |
| P352 | Tvätta med mycket tvål och vatten. |
| P353 | Skölj huden med vatten/dusch. |
| P360 | Skölj omedelbart kontaminerade kläder och hud med mycket vatten innan du tar av kläderna. |
| P361 | Ta genast av alla nedstänkta kläder. |
| P362 | Ta av förorenade kläder och tvätta dem före återanvändning. |
| P363 | Tvätta förorenade kläder före återanvändning. |
| P370 | Vid brand: |
| P371 | Vid större brand och stora mängder: |
| P372 | Explosionsrisk vid brand. |
| P373 | Släck INTE eld när elden når sprängämnen. |
| P374 | Bekämpa brand med normala försiktighetsåtgärder på rimligt avstånd. |
| P376 | Stoppa läckan om det är säkert att göra det.Oxiderande gaser (avsnitt 2.4) 1 |
| P377 | Läckande gasbrand: Släck inte, såvida inte läckan kan stoppas på ett säkert sätt. |
| P378 | |
| P380 | Evakuera området. |
| P381 | Eliminera alla antändningskällor om det är säkert att göra det. |
| P390 | Absorbera spill för att förhindra materiella skador. |
| P391 | Samla upp spill.Farligt för vattenmiljön |
| P301 + P310 | VID FÖRTÄRING: Kontakta omedelbart en GIFTINFORMATIONSCENTRAL eller läkare. |
| P301 + P312 | VID FÖRTÄRING: kontakta GIFTINFORMATIONSCENTRAL eller läkare OM du mår dåligt. |
| P301 + P330 + P331 | VID FÖRTÄRING: Skölj munnen.Framkalla INTE kräkning. |
| P302 + P334 | VID HUDKONTAKT: Sänk ned i kallt vatten/linda in våta bandage. |
| P302 + P350 | VID HUDKONTAKT: Tvätta försiktigt med mycket tvål och vatten. |
| P303 + P361 + P353 | VID HUDKONTAKT (eller håret): Ta omedelbart av/ta av alla förorenade kläder.Skölj HUDEN med vatten/dusch. |
| P304 + P312 | VID INANDNING: Kontakta GIFTINFORMATIONSCENTRAL eller läkare om du mår dåligt. |
| P304 + P340 | VID INANDNING: Flytta den skadade till frisk luft och låt vila i en ställning som underlättar andningen. |
| P304 + P341 | VID INANDNING: Vid andningssvårigheter, flytta den skadade till frisk luft och låt vila i en ställning som underlättar andningen. |
| P305 + P351 + P338 | VID KONTAKT MED ÖGONEN: Skölj försiktigt med vatten i flera minuter.Ta bort kontaktlinser, om sådana finns och lätt att göra.Fortsätt skölja. |
| P306 + P360 | VID PÅ KLÄDER: Skölj omedelbart förorenade KLÄDER och HUD med mycket vatten innan du tar av kläderna. |
| P307 + P311 | VID exponering: kontakta GIFTINFORMATIONSCENTRAL eller läkare. |
| P308 + P313 | VID exponering eller oro: Sök läkarhjälp. |
| P309 + P311 | VID exponering eller om du känner dig illamående: kontakta GIFTINFORMATIONSCENTRAL eller läkare. |
| P332 + P313 | OM HUDirritation uppstår: Sök läkarhjälp. |
| P333 + P313 | OM HUDirritation eller hudutslag uppstår: Sök läkarhjälp. |
| P335 + P334 | Borsta bort lösa partiklar från huden.Doppa i kallt vatten/linda in i våta bandage. |
| P337 + P313 | OM ögonirritation kvarstår: Sök läkarhjälp. |
| P342 + P311 | OM du upplever luftvägssymtom: kontakta GIFTINFORMATIONSCENTRAL eller läkare. |
| P370 + P376 | Vid brand: Stoppa läckan om det är säkert att göra det. |
| P370 + P378 | Vid brand: |
| P370 + P380 | Vid brand: Evakuera området. |
| P370 + P380 + P375 | Vid brand: Evakuera området.Bekämpa brand på distans på grund av explosionsrisk. |
| P371 + P380 + P375 | Vid större brand och stora mängder: Evakuera området.Bekämpa brand på distans på grund av explosionsrisk. |
Lagring
| Koda | Fras |
| P401 | |
| P402 | Förvara på en torr plats. |
| P403 | Förvara på en väl ventilerad plats. |
| P404 | Förvaras i en sluten behållare. |
| P405 | Förvara inlåst. |
| P406 | Förvaras i korrosionsbeständig/ behållare med resistent innerfoder. |
| P407 | Upprätthåll luftgap mellan staplar/pallar. |
| P410 | Skydda från solljus. |
| P411 | |
| P412 | Utsätt inte för temperaturer över 50 oC/ 122 oF. |
| P413 | |
| P420 | Förvaras åtskilt från andra material. |
| P422 | |
| P402 + P404 | Förvara på en torr plats.Förvaras i en sluten behållare. |
| P403 + P233 | Förvara på en väl ventilerad plats.Förvara behållaren väl tillsluten. |
| P403 + P235 | Förvara på en väl ventilerad plats.Håll dig svalt. |
| P410 + P403 | Skydda från solljus.Förvara på en väl ventilerad plats. |
| P410 + P412 | Skydda från solljus.Utsätt inte för temperaturer över 50 oC/122oF. |
| P411 + P235 | Håll dig svalt. |
Förfogande
| Koda | Fras |
| P501 | Kassera innehållet/behållaren till... |
| P502 | Kontakta tillverkaren/leverantören för information om återvinning/återvinning |
Fysiska faror
| Koda | Fras |
| H200 | Instabilt sprängämne |
| H201 | Explosiv;risk för massexplosion |
| H202 | Explosiv;allvarlig projektionsrisk |
| H203 | Explosiv;brand-, explosions- eller projektionsrisk |
| H204 | Brand- eller projektionsrisk |
| H205 | Kan massa explodera i eld |
| H220 | Extremt brandfarlig gas |
| H221 | Brandfarlig gas |
| H222 | Extremt brandfarlig aerosol |
| H223 | Brandfarlig aerosol |
| H224 | Extremt brandfarlig vätska och ånga |
| H225 | Mycket brandfarlig vätska och ånga |
| H226 | Brandfarlig vätska och ånga |
| H227 | Brännbar vätska |
| H228 | Brandfarligt fast ämne |
| H229 | Tryckbehållare: kan spricka vid upphettning |
| H230 | Kan reagera explosivt även i frånvaro av luft |
| H231 | Kan reagera explosivt även i frånvaro av luft vid förhöjt tryck och/eller temperatur |
| H240 | Uppvärmning kan orsaka en explosion |
| H241 | Uppvärmning kan orsaka brand eller explosion |
| H242 | Uppvärmning kan orsaka brand |
| H250 | Antar spontant om den utsätts för luft |
| H251 | Självuppvärmning;kan fatta eld |
| H252 | Självuppvärmning i stora mängder;kan fatta eld |
| H260 | Vid kontakt med vatten frigörs brandfarliga gaser som kan antändas spontant |
| H261 | Vid kontakt med vatten frigörs brandfarlig gas |
| H270 | Kan orsaka eller intensifiera brand;oxidationsmedel |
| H271 | Kan orsaka brand eller explosion;starkt oxidationsmedel |
| H272 | Kan intensifiera elden;oxidationsmedel |
| H280 | Innehåller gas under tryck;kan explodera vid upphettning |
| H281 | Innehåller kyld gas;kan orsaka kryogena brännskador eller skador |
| H290 | Kan vara frätande för metaller |
Hälsorisker
| Koda | Fras |
| H300 | Dödlig vid förtäring |
| H301 | Giftigt vid förtäring |
| H302 | Farligt vid förtäring |
| H303 | Kan vara skadligt vid förtäring |
| H304 | Kan vara dödligt vid förtäring och kommer ner i luftvägarna |
| H305 | Kan vara skadligt vid förtäring och kommer ner i luftvägarna |
| H310 | Dödlig vid hudkontakt |
| H311 | Giftigt vid hudkontakt |
| H312 | Farligt vid hudkontakt |
| H313 | Kan vara skadligt vid hudkontakt |
| H314 | Orsakar allvarliga brännskador på huden och ögonskador |
| H315 | Orsakar hudirritation |
| H316 | Orsakar mild hudirritation |
| H317 | Kan orsaka en allergisk hudreaktion |
| H318 | Orsakar allvarliga ögonskador |
| H319 | Orsakar allvarlig ögonirritation |
| H320 | Orsakar ögonirritation |
| H330 | Dödligt vid inandning |
| H331 | Giftigt vid inandning |
| H332 | Skadligt vid inandning |
| H333 | Kan vara skadligt vid inandning |
| H334 | Kan orsaka allergi- eller astmasymtom eller andningssvårigheter vid inandning |
| H335 | Kan orsaka irritation i luftvägarna |
| H336 | Kan orsaka dåsighet eller yrsel |
| H340 | Kan orsaka genetiska defekter |
| H341 | Misstänks för att orsaka genetiska defekter |
| H350 | Kan orsaka cancer |
| H351 | Misstänkt för att orsaka cancer |
| H360 | Kan skada fertiliteten eller det ofödda barnet |
| H361 | Misstänks skada fertiliteten eller det ofödda barnet |
| H361d | Misstänks för att skada det ofödda barnet |
| H362 | Kan skada barn som ammas |
| H370 | Orsakar skador på organ |
| H371 | Kan orsaka skador på organ |
| H372 | Orsakar skador på organ genom långvarig eller upprepad exponering |
| H373 | Kan orsaka skador på organ genom långvarig eller upprepad exponering |
Miljöfaror
| Koda | Fras |
| H400 | Mycket giftigt för vattenlevande organismer |
| H401 | Giftigt för vattenlevande organismer |
| H402 | Skadligt för vattenlevande organismer |
| H410 | Mycket giftigt för vattenlevande organismer med långvariga effekter |
| H411 | Giftigt för vattenlevande organismer med långvariga effekter |
| H412 | Skadligt för vattenlevande organismer med långvariga effekter |
| H413 | Kan orsaka långvariga skadliga effekter på vattenlevande organismer |
| H420 | Skadar folkhälsan och miljön genom att förstöra ozon i den övre atmosfären |
Tillämpning i syntes av [ 5402-55-1 ]
Uppströms syntesväg för [5402-55-1]
Nedströms syntetisk väg av [ 5402-55-1 ]
Uppströms syntesväg för [5402-55-1]
| Avkastning | Reaktionsvillkor | Operation i experiment |
|---|---|---|
| 72 % | Med stam av zygomycete-svampen S.racemosum MUT 770 I dimetylsulfoxid i 72 timmar;Enzymatisk reaktion | 2.3.Biotransformationsexperiment Svampstammar förodlades i petriskålar innehållande fast maltextraktmedium (MEA: 20 g L−1 glukos, 20 g L−1 maltextrakt, 20 g L−1 agar, 2 g L−1 pepton) från vilken inokulatet för flytande kulturer inrättades.Svampen inokulerades som konidiesuspension (1 106 konidier/ml) i 50 ml ask innehållande 40 ml flytande maltextraktmedium.Kolvar inkuberades vid 25 C och hölls under omrörning (110 rpm). Efter 2 dagars förväxt tillsattes en 500 mM lösning av substratet DMSO, till en utgångssubstratkoncentration (c0) på 1–5 mM.För varje substrat kördes tre biologiska replikat. Experimentet kördes i 3 dagar efter tillsatsen av substraten, under vilken tid 1 ml prover togs, med bestämda intervall (vanligtvis 24, 48 och 72 timmar).Varje prov extraherades med EtOAc (500 L), den organiska fasen torkades över vattenfritt Na2S04 och analyserades med hjälp av GC/MS.I vissa fall (se avsnitt 2.4) har isoleringen av den reducerade produkten utförts. För varje uppsättning biotransformationer användes en fråga för att mäta den initiala biomassan och pH-värdet före tillsatsen av substratet. Dessa parametrar var också utvärderas i slutet av experimentet för alla frågor.Det flytande mediet separerades från biomassan genom filtrering och användes för pH-mätning medan myceliet torkades vid 60 C under 24 timmar för att mäta biomassans torrvikt.2-(tiofen-2-yl)etanol: från 2-(tiofen-2-yl)ättiksyra (3,7 mg, 72 procent) och från metyl-2-(tiofen-2-yl)acetat (24,6 mg, 96 procent).IH NMR (400 MHz, CDCI3, TMS): = 7,20 (m, IH, heteroaromatiskt väte), 6,99 (m, IH, heteroaromatiskt väte), 6,90 (m, IH, heteroaromatiskt väte), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02 (t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCI3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
| 66,5 % | Steg #1: Med litiumaluminiumtetrahydrid i tetrahydrofuran vid 0 - 20 ℃; Steg #2: Med vatten;natriumklorid i tetrahydrofuran vid 0 ℃; | Steg 9 2-(tiofen-2-yl)etanol: Vid ca 0°C sattes droppvis en lösning av tiofen-2-ylättiksyra (1,0 g; 7,03 mmol) i tetrahydrofuran (10 ml) till en suspension av litiumaluminiumhydrid (0,534 g; 14,05 mmol) i torrt material tetrahydrofuran (10 ml). Blandningen omrördes vid rumstemperatur under cirka 4 timmar och kyldes sedan till cirka 0°C. Efter tillsats av en kall mättad natriumkloridlösning (1 ml), filtrerades blandningen och de oorganiska salterna tvättades med tetrahydrofuran och etylacetat. Filtratet och tvättvätskorna kombinerades och koncentrerades i vakuum för att ge titelföreningen som brun olja (0,600 g; 66,5 procent). 1H NMR (400 MHz, CDCI3) δ 1,60 (br, utbytbar med D2O, IH), 3,08 (t, J=6,2 Hz, 2H), 3,85 (t, J=6,2 Hz, 2H), 6,87-6,88 (m, IH), 6,95-6,97 (m, IH), 7,16-7,25 (m, IH).IR (film) υ 3345, 3105, 2211, 2126, 2090, 1792, 1433, 1138, 972, 737, 699 cm-1MS: 129 (M+1). |
| Avkastning | Reaktionsvillkor | Operation i experiment |
|---|---|---|
| 96 % | Med stam av zygomycete-svampen S.racemosum MUT 770 I dimetylsulfoxid i 72 timmar;Enzymatisk reaktion | 2.3.Biotransformationsexperiment Svampstammar förodlades i petriskålar innehållande fast maltextraktmedium (MEA: 20 g L−1 glukos, 20 g L−1 maltextrakt, 20 g L−1 agar, 2 g L−1 pepton) från vilken inokulatet för flytande kulturer inrättades.Svampen inokulerades som konidiesuspension (1 106 konidier/ml) i 50 ml ask innehållande 40 ml flytande maltextraktmedium.Kolvar inkuberades vid 25 C och hölls under omrörning (110 rpm). Efter 2 dagars förväxt tillsattes en 500 mM lösning av substratet DMSO, till en utgångssubstratkoncentration (c0) på 1–5 mM.För varje substrat kördes tre biologiska replikat. Experimentet kördes i 3 dagar efter tillsatsen av substraten, under vilken tid 1 ml prover togs, med bestämda intervall (vanligtvis 24, 48 och 72 timmar).Varje prov extraherades med EtOAc (500 L), den organiska fasen torkades över vattenfritt Na2S04 och analyserades med hjälp av GC/MS.I vissa fall (se avsnitt 2.4) har isoleringen av den reducerade produkten utförts. För varje uppsättning biotransformationer användes en fråga för att mäta den initiala biomassan och pH-värdet före tillsatsen av substratet. Dessa parametrar var också utvärderas i slutet av experimentet för alla frågor.Det flytande mediet separerades från biomassan genom filtrering och användes för pH-mätning medan myceliet torkades vid 60 C under 24 timmar för att mäta biomassans torrvikt.2-(tiofen-2-yl)etanol: från 2-(tiofen-2-yl)ättiksyra (3,7 mg, 72 procent) och från metyl-2-(tiofen-2-yl)acetat (24,6 mg, 96 procent).IH NMR (400 MHz, CDCI3, TMS): = 7,20 (m, IH, heteroaromatiskt väte), 6,99 (m, IH, heteroaromatiskt väte), 6,90 (m, IH, heteroaromatiskt väte), 3,85 (t, 2H, J = 6,2 Hz, CH2OH), 3,02 (t, 2H, J = 6,2 Hz, CH2CH2OH).13C NMR (100 MHz, CDCI3, TMS): = 140,5, 127,0, 125,8, 124,0, 63,4, 33,3.GC/MS: tR = 9,47 min, m/z128 (M+, 30), 110 (5), 97 (100) |
Nedströms syntetisk väg av [ 5402-55-1 ]
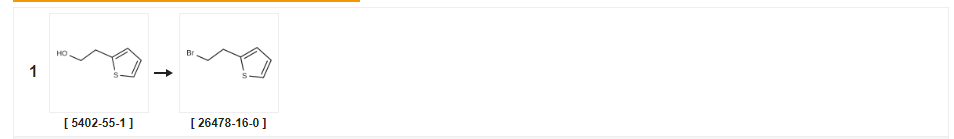
| Avkastning | Reaktionsvillkor | Operation i experiment |
|---|---|---|
| 94 % | Med koltetrabromid;trifenylfosfin i tetrahydrofuran vid 0 ℃;Schlenk teknik;Inert atmosfär; | |
| 69 % | Med brom;trifenylfosfin i diklormetan vid 20 ℃; | |
| 64 % | S.31 Syntes av 2-(2-brometyl)tiofen Framställningsexempel 31 Syntes av 2-(2-brometyl)tiofen 2-tienyletanol (0,44 ml) behandlades som i ovanstående produktionsexempel 1 för att ge titelföreningen (0,490 g) som en färglös olja (utbyte: 64,0%).IH-NMR (400 MHz, CDCI3): 5(ppm) 3,38(2H, t, J=7,6Hz), 3,58(2H, t, J=7,6Hz), 6,89(IH, d, J=1,2Hz), 6,96 (IH, d, J=4,2 Hz), 7,19 (IH, dd, J=1,2, 4,2 Hz). |
| 28 % | Med fosfortribromid i diklormetan vid 0 - 20 ℃;under 1 h; | |
| 19 % | Med fosfortribromid i tetraklormetan vid 65 ℃;för 0,333333h; | a Fosfortribromid (2,0 ml, 21,1 mmol) sattes till en omrörd lösning av 2-(tiofen-2-yl)etanol (2,25 g, 17,6 mmol) i koltetraklorid (162 ml) och sedan värmdes blandningen till 65°C för 20 minuter.Blandningen fick svalna till rumstemperatur och sedan tillsattes is.Det organiska skiktet separerades och sedan extraherades det vattenhaltiga skiktet med diklormetan (2 x 30 ml).De kombinerade organiska skikten tvättades med saltlösning, torkades sedan (NaS04), filtrerades och reducerades i vakuum.Återstoden renades genom snabbkromatografi över kiseldioxid under eluering med etylacetat:hexanblandningar 0:100 till 0,5:95,5 för att ge 2-(2-brometyl)tiofen som en brun olja (650 mg, 19%). |
| Med pyridin;kloroform;fosfortribromid | ||
| Med fosfortribromid i dietyleter vid 0 ℃;i 4h; | 2D Exempel 2D;9-(4,5-dimetyl-tiazol-2-yl)-4-[4-(2-tiofen-2-yl-etyl)-piperazin-1-yl]-5,6,7, 8-TETRAHYDRO- 1, 3, 4B-TRIAZA-FLUOREN Till en lösning av 2-(2-tienyl)etanol (1,63 g) i torr eter (15 ml) vid 0°C sattes PBr3 (1,31 ml) droppvis.Efter 4 timmar späddes reaktionsblandningen med diklormetan, tvättades med vatten, torkades (MGS04) och lösningsmedlet avlägsnades i vakuum för att ge en brun olja som renades med snabbkromatografi för att ge 2-(2-bromo-etyl)-tiofen.En blandning av 9-(4,5-DIMETYL-TIAZOL-2-YL)-4-PIPERAZIN-1-YL-5, 6,7, 8-TETRAHYDRO-1, 3, 4b-triaza-fluoren (85 mg), 2-(2-brom-etyl)-tiofen (44 mg) och kaliumkarbonat (38 mg) upphettades till återflöde i acetonitril (5 ml) under 4 timmar.Reaktionsblandningen kyldes, extraherades i diklormetan, torkades (MGS04) och lösningsmedlet avlägsnades i vakuum för att ge råprodukt som renades med snabbkromatografi för att ge titelföreningen (30 mg). |
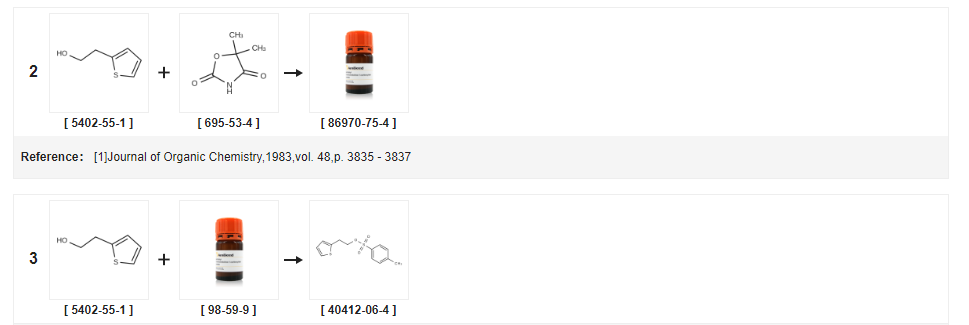
| Avkastning | Reaktionsvillkor | Operation i experiment |
|---|---|---|
| 98 % | Med trietylamin;vid 35 ℃;Kylning med is; | (0,87 mol) 2-tiofenetanol och 184 g (0,97 mol) p-toluensulfonylklorid sattes sekventiellt till en 1 L trehalsad kolv, 98 g (0,97 mol) trietylamin tillsattes droppvis under isvattenbad, Och håll temperaturen på reaktionsvätskan inte högre än 20°C, droppen avslutad, upphettning till 35°C för att fortsätta omrörningen, respektive 24h, 27h provtagning, TLC, tills reaktionen är avslutad, stoppa reaktion, filtrering, filterkaka med lämplig mängd diklormetan Och metylenkloridskiktet torkades med vattenfritt natriumsulfat under 2 timmar.Torkmedlet filtrerades av och torkmedlet tvättades med en liten mängd metylenklorid.Filtratet dekomprimerades i vakuum och filtratet indunstades under reducerat tryck.Koncentrerad till konstant vikt för att bli brun olja, vägande 203 g, utbyte 98 %, |
| 96,37 % | Med trietylamin;I toluen;vid 5 - 30 ℃;i 20.8333h;Produktdistribution/selektivitet; | EXEMPEL 3 Framställning av 2-tienyletyl-para-toluensulfonat (formel VII) Med användning av toluen 400 liter toluen och 163,2 kg para-toluensulfonylklorid satsades i en ren och torr reaktor följt av kylning till ca 5 C. 100 kg tiofen 2-etanol tillsattes vid cirka 5 C under cirka 20 minuter följt av tillsats av 130 kg trietylamin under cirka 8 timmar, 50 minuter.Reaktionsblandningens temperatur höjdes till ca 30°C följt av omrörning i ca 12 timmar.Reaktionsmassan filtrerades genom ett Nutsche-filter och tvättades med 2 x 100 liter toluen.Reaktionsfiltratet överfördes till en annan reaktor följt av tvättning med 5 x 200 liter vatten.Organiska och vattenhaltiga skikt separerades och det organiska skiktet destillerades fullständigt vid ca under 70°C under vakuum för att ge 212 kg (utbyte: 96,37%) av titelföreningen.Renhet enligt GC: 95,59%. |
| 96,5 % | Med trietylamin;I diklormetan;vid -5 - 20 ℃;i 2h; | 32,7 g (0,17 mol) p-toluensulfonylklorid, 40 ml diklormetan i reaktionskolven, kyld till -5 C, 20 g (0,16 mol) 2-tiofenetanol. 28,4 g (0,28 mol) trietylamin tillsattes långsamt droppvis och temperaturen för reaktionslösningen hölls vid ca 0 C. Plus Bi, inkuberades i 2 timmar efter att reaktionen värmts till rumstemperatur.2-tiofenetanol förbrukas tills råmaterialen, sugfiltrering, Fastämnet tvättades med en liten mängd metylenklorid och filtratet tvättades med 50 ml mättad natriumbikarbonat och torkades över vattenfritt natriumsulfat.Filtrering, koncentration av filtratet, ljusbrunt fast material fälldes ut, Filtrerad, tvättad med en liten mängd petroleumeter till vit, Dvs P-toluensulfonat-2-tiofenetylester 42,5 g, utbyte 96,5 % (HPLC-renhet 99 %) |
| 95,5 % | Med trietylamin;I diklormetan;vid 7,5 - 22,5 ℃;i 5h;Produktdistribution/selektivitet; | EXEMPEL 10 Framställning av 2-(2-tiofen)etanoltosylat (formel VII) Med användning av diklormetan 4 liter diklormetan sattes till en reaktor vid en temperatur av cirka 30 C, kyld till en temperatur av cirka 7,5 C, till vilken tillsatte 1,784 kg p-toluensulfonylklorid följt av 1 kg tiofen-2-etanol.1,302 kg trietylamin sattes till ovanstående reaktionsmassa vid en temperatur av ca 7,5 C följt av långsam höjning av reaktionsmassans temperatur till 22,5 C under ca 5 timmar.Den erhållna reaktionsmassan filtrerades genom ett tryck Nutsche-filter, tvättades med metylenklorid (2 x 1 liter) och moderluten uppsamlades och överfördes till en annan reaktor.Det organiska skiktet tvättades med vatten (5 x 2 liter).Det så erhållna organiska skiktet utsattes för destillation vid en temperatur under 70 C med användning av varmvattencirkulation.Den erhållna återstoden kyldes sedan till ca 30°C för att ge 2,1 kg (utbyte: 95,5%) av titelföreningen. |
| 93,6 % | Med trietylamin;I toluen;vid 45 ℃;i 4h; | Exempel 1 0,2.Omvandling av (S)-1,2,3,4-tetrahydro-5-hvdroxi-N-propyl-naftalen-2-ammoniumhydrobromid (VIII) till hydrokloridsalt av rotigotin;10.2.1.Framställning av 2-(2-tienyl)etyl-4-toluensulfonat;4-toluensulfonylklorid (162 g), toluen (363,3 g) och 2-(2-tienyl)etanol (104 g) kombineras.Trietylamin (93 g) tillsätts medan temperaturen hålls lägre än 45 C. Efter 4 timmar tvättas blandningen med vattenhaltig fosforsyra, vattenhaltig natriumhydroxid och sedan vatten.Den organiska fasen avdestilleras under vakuum.Isopropanol (314 g) och heptaner (365,9 g) tillsätts.Satsen kristalliseras genom kylning och isoleras vid -15 C. Kristallerna filtreras och tvättas med heptaner (175 ml).Kristallerna torkas sedan under vakuum vid rumstemperatur tills en smältpunkt av > 30 C erhålls. Utbyte (214 g): 93,6 % HPLC-analyser bekräftade renhet >99 % och 100 % analys i jämförelse med en referensstandard. |
| 93,6 % | Med trietylamin;I toluen;vid 45 ℃;i 4h; | 4-toluensulfonylklorid (162 g), toluen (363,3 g) och 2-(2-tienyl)etanol (104 g) kombineras.Trietylamin (93 g) tillsätts varvid temperaturen hålls lägre än 45 C. Efter 4 timmar tvättas blandningen med vattenhaltig fosforsyra, vattenhaltig natriumhydroxid och därefter vatten.Den organiska fasen avdestilleras under vakuum.Isopropanol (314 g) och heptaner (365,9 g) tillsätts.Satsen kristalliseras genom kylning och isoleras vid -15 C. Kristallerna filtreras och tvättas med heptaner (175 ml).Kristallerna torkas sedan under vakuum vid rumstemperatur tills en smältpunkt av 30 C erhålls.Utbyte (214 g): 93,6 % |
| 90 % | Med silikagel;I diklormetan;under 2 timmar; Återflöde; | 12,8 g (0,1 mol) 2-(2-tienyl) etanol, 1000 ml diklormetan, 21,0 g (0,12 mol) p-toluensulfonsyraklorid och 10,0 g silikagel i reaktionskolven, reaktionsblandningen återloppskokades i 2 timmar, kyldes, filtrerades för att avlägsna silikagel. Reaktionsblandningen tvättades successivt med destillerat vatten, mättad natriumkarbonatlösning, saltlösning, därefter avlägsnades metylenkloridlösningsmedlet genom destillation under reducerat tryck för att ge 26,0 g p-toluensulfonsyra Framställning av 2 -(2-tienyl)etylester, 90% utbyte. |
| I pyridin;vatten; | (a) 2-(2-hydroxietyl)tiofentosylat Toluen-4-sulfonylklorid (4,125 g) sattes portionsvis under 5 minuter till en iskall lösning av 2-(2-hydroxietyl)tiofen (1,723 g) i vattenfri pyridin (20 ml) och den resulterande blekgula lösningen omrördes vid 0°C. Efter 3 timmar hälldes reaktionsblandningen i kraftigt omrört vatten (160 ml), vilket gav en fällning.Efter kylning uppsamlades det fasta ämnet och tvättades med vatten för att ge vita kristaller av titeltosylatet (3,555 g), smp. 33-34°C, lambdamax (EtOH) 227 nm (E11 612). | |
| Med trietylamin;I butanon;vid 0 - 30 ℃; | Exempel 1 Framställning av 2-(2-tienyl)-etyl-para-toluensulfonat En blandning av p-toluensulfonylklorid (328 g) och 2-(2-tienyl)-etanol (200 g) i metyletylketon (1000 ml) kyldes till 0C.Detta följdes av droppvis tillsats av trietylamin (283,1 ml) vid 0-5°C under en period av 1 till 2 timmar, och reaktionsmassan omrördes i 12 till 15 timmar vid 25-30°C.Den resulterande massan filtrerades och tvättades med metyletylketon (500 ml).Det resulterande organiska skiktet tvättades med vatten (500 ml) följt av tvättningar med mättad natriumbikarbonatlösning (500 ml) och saltlösning (500 ml).Det resulterande organiska skiktet destillerades under vakuum vid under 50°C för att ge 2-(2-tienyl)-etyl-para-toluensulfonat som en oljig massa (oljans vikt: 505 g; Renhet enligt HPLC: 97%). | |
| Med trietylamin;I butanon;vid 0 - 30 ℃; | Exempel 1 Framställning av 2-(2-tienyl)-etyl-para-toluensulfonat En blandning av p-toluensulfonylklorid (328 g) och 2-(2-tienyl)-etanol (200 g) i metyletylketon (1000 ml) kyldes till 0 C. Detta följdes av droppvis tillsats av trietylamin (283,1 ml) vid 0-5 C under en period av 1 till 2 timmar, och reaktionsmassan omrördes i 12 till 15 timmar vid 25-30 C. Den resulterande massan filtrerades och tvättades med metyletylketon (500 ml).Det resulterande organiska skiktet tvättades med vatten (500 ml) följt av tvättningar med mättad natriumbikarbonatlösning (500 ml) och saltlösning (500 ml).Det resulterande organiska skiktet destillerades under vakuum vid under 50°C för att ge 2-(2-tienyl)-etyl-para-toluensulfonat som en oljig massa (oljans vikt: 505 g; Renhet enligt HPLC: 97%). | |
| Med kaliumkarbonat;I toluen;vid 0 - 20 ℃;under 3,5 timmar; | 500 ml toluen sattes till en 1000 ml reaktionskolv, 50 g Tiofenetanol Och 80 g p-toluensulfonylklorid, Slå på omrörning, Reglerad temperatur tillsattes droppvis vid 0 C64 g kaliumkarbonat, Tillsättningen fortsatte i ca 30 min. avslutade uppvärmningen till 20 C reaktion i 3 timmar, Till reaktionslösningen sattes 400 ml vatten, Tvättad två gånger, Det tvättade toluenskiktet användes direkt för nästa reaktion. | |
| Med N-etyl-N,N-diisopropylamin;I toluen;vid 0 - 20 ℃;under 3,5 timmar; | 500 ml toluen sattes till en 1000 ml reaktionskolv, 50 g tiofenetanol och 92 g p-toluensulfonylklorid, omrörd vid 0°C, droppades 62 g N,N-diisopropyletylamin i ca 30 min.När droppningen var fullbordad upphettades blandningen till 20°C och fick reagera i 3 timmar.Till reaktionslösningen sattes 400 ml vatten, tvättad två gånger, det tvättade toluenskiktet användes direkt för nästa reaktion. | |
| Med trietylamin;I toluen;vid 0 - 20 ℃;i 3h; | 500 ml toluen, 50 g tiofenetanol och 80 g p-toluensulfonylklorid placerades i en 1000 ml reaktionskolv, och temperaturen höjdes till 20 C under 3 timmar.400 ml vatten sattes till reaktionslösningen, tvättades två gånger, tvättades med toluen, skikt direkt till nästa stegs reaktion. | |
| Med kaliumkarbonat;I toluen;vid 0 - 20 ℃;under 3,5 timmar; | 500 ml toluen, 50 g tiofenetanol och 107 g p-toluensulfonylklorid placerades i en 1000 ml reaktionskolv, omröring sattes på, temperaturen reglerades till 0 C, droppvis tillsats av 64 g kaliumkarbonat, tillsatsen varade ca. 30 min, varefter den värmdes till 20 C och reagerades i 3 timmar, tillsattes till reaktionslösningen 400 ml vatten, tvättades två gånger, och det tvättade toluenskiktet användes direkt för nästa reaktion. | |
| Med trietylamin;I toluen;vid 0 - 25 ℃;under 3,5 timmar; | Exempel 1 Framställningsmetoden för tiklopidinhydroklorid som visas i fig. 2 innefattar följande steg:1.p-toluensulfonylskydd: I en 1000 ml reaktionskolv satsades 500 ml toluen, 50 g tiofenetanol och 80 g p-toluensulfonylklorid och omrördes för kontroll. Vid en temperatur av 0 C tillsattes droppvis 47 g trietylamin, droppande i cirka 30 minuter, och temperaturen höjdes till 25 C under 3 timmar. Tillsätt 400 ml vatten, tvättad två gånger, tvättad med toluenskikt direkt till nästa steg reaktion.2.Kondensationsreaktion Reaktionslösningen av toluen i föregående steg sattes till en 1000 ml reaktionskolv, följt av tillsats av 114 g o-klorbensylamin och upphettning till 90 C under 3 timmar.Efter reaktionen kyldes blandningen till 25°C och omrördes i 1 timme.Filtratet sattes med 200 ml vatten och saltsyra. Justera systemets pH till 8,5, stratifiera det övre skiktet av toluen och fortsätt droppa saltsyra för att justera pH till 5, kyl sedan systemet till 2 C Kristallerna blandades för 4 timmar och filtrerades, och filterkakan torkades i vakuum vid 50 C för att ge 96 g av kondensatet hydroklorid.Reaktion med sluten krets Till 1000 ml reaktionskolven sattes 96 g av kondensatet hydroklorid, 400 ml 1,3-dioxan och 5 ml saltsyra, till 90 C under 6 timmar.Efter reaktionen kyldes blandningen till 7°C och omrördes i 3 timmar.Filterkakan tvättades med en liten mängd 1,3-dioxetan. Efter 50 C vakuumtorkning erhölls 95 g tiklopidinhydroklorid4 ?Raffinerad I en 1000 ml reaktionskolv tillsattes 95 g rå tiklopidinhydroklorid och 500 ml absolut etanol och värmdes till 72 C under omrörning, ca 10 minuter efter att det fasta ämnet är helt upplöst genom att tillsätta 2 g aktivt kol, isoleringsblekning 20 minuter efter varmt filter, filtratet svalnade gradvis. Kristallerna kristalliserades vid 4 C under 4 timmar och filtrerades.Filterkakan tvättades med en liten mängd absolut etanol och torkades i vakuum vid 50°C för att ge 91 g titiolhydrokloridPrecision-produkter.Totalt utbyte 82 %, renhet 99,9 % | |
| Med natriumhydroxid;I vatten;toluen;vid 10 - 55 ℃;i 11 timmar; | I en trehalsad kolv placerades 97 g p-toluensulfonylklorid och 180 ml toluen. Rör om och lös upp, filtrera, håll varmt vid 15-20 C, 60 g 2-tiofenetanol och 60 ml toluen placerades i en trehalsad kolv.120 g 40% vattenhaltig natriumhydroxid, omrörning, En lösning av 97 g p-toluensulfonylklorid löst i 180 ml toluen tillsattes droppvis vid 10-20 C, och blandningen omrördes i 3 timmar, sedan upphettas till 45-55 C i 8 timmar och får stå för stratifiering. Den organiska fasen sänks trycket för att avlägsna toluen för att ge 2-(2-tiofen)etanol-p-toluensulfonat. Rödbrun olja;molekylformeln är följande: | |
| 235,1 g | Med natriumhydroxid;I kloroform;vid 0 - 5 ℃;i 12 timmar; | Till reaktionskolven, steg 2-tiofenetanol ovan: 112 g, kloroform 600 g, PTSC 249,4 g, och blandningen kyldes till 0-5 C. Tillsätt 834 g 10 viktprocent natriumhydroxidlösning, kontrollera temperaturen 0 -5 C, håll varmt i 12 timmar, tillsätt saltsyra till pH=12, skikt, vattenskiktet extraheras med 300 g kloroform, och kloroformskiktet kombineras.Efter tvättning med 100 g vatten destillerades det organiska skiktet till torrhet för att ge 2-tiofenetanol p-toluensulfonat: 235,1 g utbyte 95,3%, renhet 99,5%. |
Skriv ditt meddelande här och skicka det till oss

![[ CAS nr. 5402-55-1 ] 2-Tiofenetanol Utvald bild](https://www.ohlsenwin.com/uploads/p1.png)
![[CAS nr. 5402-55-1] 2-tiofenetanol](https://www.ohlsenwin.com/uploads/p1-300x300.png)
![[CAS nr. 5402-55-1] 2-tiofenetanol](https://www.ohlsenwin.com/uploads/product-2-300x300.png)
![[CAS nr. 5402-55-1] 2-tiofenetanol](https://www.ohlsenwin.com/uploads/product-1-300x300.png)





![[CAS nr. 141109-14-0] (S)-metyl-2-amino-2-(2-klorfenyl)acetat](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-2-300x300.png)
![[CAS nr. 141109-19-5] (S)-metyl-2-(2-klorfenyl)-2-((2-(tiofen-2-yl)etyl)amino)acetathydroklorid](https://www.ohlsenwin.com/uploads/Chlorophenylglycine-methyl-ester-31-300x300.png)
![[CAS nr. 40412-06-4] 2-(tiofen-2-yl)etyl-4-metylbensensulfonat](https://www.ohlsenwin.com/uploads/ethanol-Tosylate-4-300x300.png)